第XIII因子
第XIII因子(だい13いんし、英: factor XIII)またはフィブリン安定化因子(fibrin stabilizing factor)は、ヒトと一部の他の動物の血液に見つかる酵素前駆体である。トロンビンによって活性化され、第XIIIa因子となる。第XIIIa因子は、血液凝固系を構成する酵素でフィブリンを架橋する。第XIII因子の欠乏は凝血の安定性を悪化させ、出血傾向を増大させる[1]。
| coagulation factor XIII, A1 polypeptide | |
|---|---|
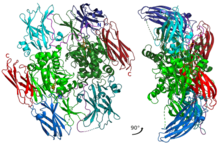 不活性状態のA1サブユニットホモ二量体。主要な触媒残基はドメインとは異なる色で示されている。 | |
| 識別子 | |
| 略号 | F13A1 |
| 他の略号 | F13A |
| Entrez | 2162 |
| HUGO | 3531 |
| OMIM | 134570 |
| RefSeq | NM_000129 |
| UniProt | P00488 |
| 他のデータ | |
| EC番号 (KEGG) | 2.3.2.13 |
| 遺伝子座 | Chr. 6 p24.2-p23 |
| coagulation factor XIII, B polypeptide | |
|---|---|
| 識別子 | |
| 略号 | F13B |
| Entrez | 2165 |
| HUGO | 3534 |
| OMIM | 134580 |
| RefSeq | NM_001994 |
| UniProt | P05160 |
| 他のデータ | |
| 遺伝子座 | Chr. 1 q31-q32.1 |
ヒトの第XIII因子はヘテロ四量体で、酵素活性を有する2つのAサブユニットと酵素活性を持たない2つのBサブユニットから構成される。第XIIIa因子は活性化されたAサブユニットの二量体である[1]。
機能
編集第XIII因子は、ヒトの血流を2つのAサブユニットと2つのBサブユニットのヘテロ四量体として循環するトランスグルタミナーゼである。血液凝固の際、トロンビンはフィブリノゲンをフィブリンへ切断し、フィブリンを基盤とした血栓が形成される。第XIII因子はBユニットを介して血栓に結合する。トロンビンはフィブリンの存在下で第XIII因子四量体内の各AサブユニットのR37-G38間のペプチド結合を効率的に切断し、AユニットはN末端の活性化ペプチドを放出する[1]。
それに伴って、非共有結合的に結合しているBユニットはカルシウムイオン(Ca2+)の助けのもとで四量体から解離できるようになる。また、カルシウムイオンは残ったAサブユニット二量体の形状を変化させて活性化する[1]。
活性化された第XIII因子(第XIIIa因子)は、血栓内のフィブリンのさまざまなグルタミンとリジン残基の間でイソペプチド結合を形成させ、フィブリンを架橋する。これらの結合は血栓を物理的により強固なものとし、酵素分解(線維素溶解)から保護する[1]。
ヒトでは、プラスミン、アンチトロンビン、TFPIが第XIIIa因子に対する最も一般的なタンパク質分解型阻害剤である。α2マクログロブリンは、重要な非タンパク質分解型阻害剤である[1]。
-
Aサブユニットの活性化ペプチド(ピンク)は、フィブリンの存在下でトロンビン(IIa)によって除去される。Bサブユニット(灰色)は、カルシウムの助けのもと解離し、Aサブユニット二量体が活性化される(XIIIa)。
-
第XIIIa因子はフィブリンを架橋する(簡略図)。
遺伝子
編集ヒトの第XIII因子はAとBのサブユニットから構成される。Aサブユニットの遺伝子はF13A1であり、6番染色体の6p24–25に位置している。長さは160 kbpにわたり、14個のイントロンと15個のエクソンを含む。mRNAの長さは3.9 kbpで、5' UTRは84 bp、3' UTRは1.6 kbpである[1]。F13A1のエクソンは
Bサブユニットの遺伝子はF13Bで、1番染色体の1q31–32.1に位置している。長さは28 kbpにわたり、11個のイントロンと12個のエクソンを含む。mRNAの長さは2.2 kbpで、エクソン2は5' UTRをコードし、エクソン2–12は10個のSushiドメインをコードする[1]。
構造
編集ヒトの血中で第XIII因子は、2つのAサブユニットと2本のBサブユニットの「ユニット」からなるヘテロ四量体として存在する。Aユニットは潜在的な触媒活性を有しているのに対し、Bユニットは有していない。Aユニットは四量体の中心部を形成している。非共有結合的に結合したBユニットは中心部の周りにリング状の構造を形成する。第XIII因子が第XIIIa因子へ活性化される際に、Bユニットは除去される。Aサブユニットのみからなる二量体は、血小板のような特定の細胞内にも存在する。血中には、Bサブユニットの単量体も大量に存在する。四量体が血液凝固に関与する一方で、このようなAサブユニット二量体やBサブユニット単量体も関与するかは不明である[1]。
Aサブユニットは約83 kDaで、731アミノ酸残基、5つのタンパク質ドメインから構成される[1]。N末端からC末端へ次のように並んでいる。
- 活性化ペプチド (1–37)
- βサンドイッチ (38–184)
- 触媒ドメイン (185–515): C314、H373、D396、W279が触媒に関与する
- βバレル1 (516–628)
- βバレル2 (629–731)
Bサブユニットは糖タンパク質である。重量は約80 kDa(重量の8.5%は炭水化物由来)、641残基で、10個のSushiドメインから構成される。各ドメインは約60残基で、ドメイン内に2つのジスルフィド結合を含む[1]。
生理学
編集ヒトの第XIII因子のAサブユニットは主に血小板と他の骨髄由来の細胞で合成される。Bサブユニットは肝細胞から血中へ分泌される。AユニットとBユニットは血中で組み合わせられてヘテロ四量体を形成する。血漿中のヘテロ四量体の濃度は14–48 mg/lで、半減期は9–14日である[1]。
第XIIIa因子によって安定化されていない血栓は5 mol/L尿素に溶解するが、安定化された血栓ではこの現象は起こらない[2]。
第XIII因子欠乏症
編集第XIII因子欠乏症は、一般的には稀であるものの存在する。世界で最も発生数が多いのはイランで、473症例が報告されている。イランの中でもスィースターン・バルーチェスターン州のKhashで最も発生数が多く、近親婚が多くみられる地域である[3]。
診断での利用
編集第XIII因子のレベルは日常的な測定は行われないが、原因不明の出血傾向を有する患者では考慮に入れてもよい。この酵素は単球やマクロファージに極めて特異的に存在するため、第XIII因子の存在の決定は、これらの細胞が関与する悪性疾患の同定や分類に利用できるかもしれない[4]。
発見
編集第XIII因子は、1948年にこの因子の存在を最初に提唱した科学者Kalman LakiとLaszlo Lorandの名に由来する、Laki–Lorand因子としても知られている[2]。2005年の会議で命名法の統一が勧奨された[4]。
出典
編集- ^ a b c d e f g h i j k l “Factor XIII: a coagulation factor with multiple plasmatic and cellular functions”. Physiological Reviews 91 (3): 931–72. (July 2011). doi:10.1152/physrev.00016.2010. PMID 21742792.
- ^ a b “On the Solubility of Fibrin Clots”. Science 108 (2802): 280. (September 1948). Bibcode: 1948Sci...108..280L. doi:10.1126/science.108.2802.280. PMID 17842715.
- ^ Factor XIII Deficiency in Iran: A Comprehensive Review of the Literature. Seminars in thrombosis and hemostasis;. 41. (2015). pp. 323–329.
- ^ a b “Factor XIII: recommended terms and abbreviations”. Journal of Thrombosis and Haemostasis 5 (1): 181–3. (January 2007). doi:10.1111/j.1538-7836.2006.02182.x. PMID 16938124.