Въглероден диоксид
| Въглероден диоксид | |||||
| |||||
| Имена | |||||
|---|---|---|---|---|---|
| По IUPAC | Въглероден диоксид | ||||
| Други | Въглероден двуокис Въглероден (IV) оксид | ||||
| Структура | |||||
| Кристална структура | тригонална | ||||
| Молекулна форма | линейна | ||||
| Свойства | |||||
| Формула | CO2 | ||||
| Моларна маса | 44,01 g/mol | ||||
| Външен вид | безцветен газ | ||||
| Плътност | 1,977 kg/m3 (1 atm и 0 °C) | ||||
| Вискозитет | 7×10−5 kg/m·s (−78,5 °C) | ||||
| Точка на топене | −56,6 °C; 216,6 K (Тройна точка – 5,1 atm) | ||||
| Сублимация | −78,5 °C; 194,7 K (1 atm) | ||||
| Парно налягане | 5,73 MPa (20 °C) | ||||
| Разтворимост във вода | 1,45 g/L (25 °C, 100 kPa) | ||||
| pKa | 6,35; 10,33 | ||||
| Магнитна възприемчивост | −20,5×10−6 cm3/mol | ||||
| Показател на пречупване | 1,00045 | ||||
| Диполен момент | 0 D | ||||
| Термохимия | |||||
| Стандартна енталпия на образуване | 394 kJ/mol | ||||
| Стандартна моларна ентропия | 213,7 J/(mol·K) (газ)[1] | ||||
| Специфичен топлинен капацитет | 37,135 J/K·mol | ||||
| Опасности | |||||
| NFPA 704 |
| ||||
| Сродни съединения | |||||
| Сродни аниони | Въглероден дисулфид, Въглероден диселенид, Въглероден дителурид | ||||
| Сродни катиони | Силициев диоксид, Германиев диоксид, Калаен диоксид, Оловен диоксид | ||||
| Сродни | Въглероден оксид, Въглероден субоксид, Дивъглероден оксид, Въглероден триоксид | ||||
| Други | Въглеродна киселина, Карбонилсулфид | ||||
| Идентификатори | |||||
| CAS номер | 124-38-9 | ||||
| PubChem | 280 | ||||
| ChemSpider | 274 | ||||
| Номер на ООН | 1013 (газ), 1845 (тв. вещество) | ||||
| DrugBank | DB09157 | ||||
| KEGG | D00004 | ||||
| MeSH | Carbon+dioxide | ||||
| ChEBI | 16526 | ||||
| ChEMBL | 1231871 | ||||
| RTECS | FF6400000 | ||||
| ATC | V03AN02 | ||||
| SMILES | O=C=O C(=O)=O | ||||
| InChI | 1S/CO2/c2-1-3 | ||||
| InChI ключ | CURLTUGMZLYLDI-UHFFFAOYSA-N | ||||
| UNII | 142M471B3J | ||||
| Gmelin | 989 | ||||
| Данните са при стандартно състояние на материалите (25 °C, 100 kPa), освен ако не е указано друго. | |||||
| Въглероден диоксид в Общомедия | |||||
Въглеродният диоксид (въглероден двуокис[2]) е химично съединение. Молекулата му се състои от един атом въглерод и два атома кислород. Химичната формула на въглеродния диоксид е CO2. Той е газ без цвят и без миризма (при ниски до средни концентрации; при високи концентрации има остра и задушлива миризма). Получава се като продукт при дишането на живите организми, както и при горенето. Участва като изходно вещество при фотосинтезата на растенията. Натрупването му в по-големи от нормалните количества в атмосферата води до парников ефект.
Химични и физични свойства
[редактиране | редактиране на кода]Въглеродният диоксид е безцветен газ. Плътността му при 25 °C е 1,98 kg/m³, която е 1,65 пъти по-голяма от тази на въздуха. Молекулата на въглеродния диоксид (O=C=O) съдържа две двойни връзки и има линейна форма. Последната няма диполен момент. Тъй като е напълно окислена, не е много реактивоспособна и в частност е невъзпламенима.
При температури под −78.5 °C въглеродният диоксид променя агрегатното си състояние от газообразно в твърдо – десублимация. Твърдият въглероден диоксид се нарича „сух лед“, процесът на получаване се нарича утаяване. При атмосферно налягане сухият лед преминава директно от твърдо в газообразно състояние при процес, наречен сублимация. Течен въглероден диоксид се получава само при налягане над 5,1 bar.
Въглеродният диоксид е разтворим във вода, при което той спонтанно се преобразува във въглеродна киселина (H2CO3) и обратно в CO2. Процесът се нарича „газиране“, а продуктът е „газирана вода“.
CO2 при големи концентрации предизвиква кисел вкус в устата и жилене (дразнение) на гърлото и носа. Тези ефекти са в резултат на образуването на слаб разтвор на въглеродна киселина на тези места.
Съдържанието на въглероден диоксид във вдишвания въздух или в някаква газова смес е субективният критерий, предизвикващ чувство на задушаване. Човек няма рецептори за недостатъчно съдържание на кислород, което е фатално.
Употреба и разпространение
[редактиране | редактиране на кода]- При производство на безалкохолни напитки
- При производството на пукащи бонбони. Тяхното производството се извършва под налягане и в присъствие на СО2
- За производство на сода бикарбонат
- Като необходим компонент за фотосинтезата. Използва се за засилване растежа на растенията при тяхното отглеждане във водни или сухоземни среди
- Като евтин незапалим газ в пожарогасителите
- В пневматичните оръжия
- Течният СО2 е добър разтворител на много органични съединения и се използва за премахване на кофеина от кафето, както и във фармацевтиката
- В медицината се използва за стимулация на дишането и при балансиране на кръвта, като се прибавя 5% СО2 към кислорода
- Течният и твърдият СО2 са много добри охладители и като такива се използват широко в хранително-вкусовата промишленост.
СО2 е крайният продукт, който организмите отделят, когато получават енергия при разграждането на захари и мазнини с кислород и е част от техния метаболизъм. Това важи и за всички растения, животни, много гъби и някои бактерии. При висшите животни СО2 се транспортира от хемоглобина в кръвта, от тъканите към белите дробове, където се отделя. При растенията участва във фотосинтезата. Океанът е един от големите консуматори на СО2.
Съдържанието на СО2 във въздуха варира между 0,03% (300 ppm) и 0,06% (600 ppm), в зависимост от района, а в издишания въздух е приблизително 4,5%. Когато СО2 се вдиша във високи концентрации (повече от 5% обемни), води моментално до опасност за живота и здравето на животните и хората. Максималното допустимо безопасно ниво за възрастни за 8-часов работен ден е 0,5% (5000 ppm), а за деца и възрастни с белодробни заболявания е значително по-ниско. Хората, които вдишат 7 – 10% СО2, могат моментално или след няколко минути да изпаднат в безсъзнание или кома.
Съдържание на СО2 в атмосферата
[редактиране | редактиране на кода]През 1953 г. американският учен Чарлз Кийлинг започва да изследва как карбонатът постига химично равновесие в разтвор от вода, варовик и атмосферен въглероден диоксид. За тази цел конструира прецизен уред, който измерва извлечения от водата СО2. В отдалечена от производствени центрове и жилищни зони местност в окръг Монтерей, щата Калифорния, Кийлинг измерва концентрация на СО2 в земната атмосфера от 310 ppm (0,031%). Скоро след това открива денонощните и годишните колебания на концентрацията на СО2 в земната атмосфера.[3]
Предвид общото тегло на земната атмосфера, което се оценява на 5,1х1018 кг, концентрация от 1 ppm означава общо съдържание на 5,1 Gt (гигатона) CO2 в нея. И понеже молекулната маса на въглеродния диоксид М(CO2) = 44, а молекулната маса на въглерода М(C) = 12, 1 ppm CO2 = 5,1 Gt (гигатона) CO2 = 1,39 Gt въглерод (С).
През 1956 г. Роджър Ревел от Института по океанография „Скрипс“ и Хари Уекслър от Метеорологичната служба на САЩ се присъединяват към изследванията на Кийлинг, като предлагат през предстоящата Година на геофизиката (1957-1958) да се проведе едно по-мащабно глобално измерване на атмосферните концентрации на CO2 в множество отдалечени и предполагаемо незасегнати от замърсяване локации. През март 1958 г. Кийлинг инсталира на Мауна Лоа първия си инфрачервен газов анализатор, който през първия ден регистрира концентрация на CO2 313 ppm (0,0313%).[3]
През 2020 г. концентрацията на СО2 в земната атмосфера вече надвишава 415 ppm (0,0415%). За периода 1958 - 2020 увеличението е около 100 ppm, което е около 1,6 ppm годишно или 22,4 милиона тона CO2 на ден.[3]
Парников ефект
[редактиране | редактиране на кода]През последните двеста години, много промишлени процеси са били използвани за производство на енергия (главно изгаряне на изкопаеми горива), които отделят големи количества въглероден диоксид в атмосферата (заедно с други замърсители). Наред с намаляването на растителността на планетата, след обезлесяването и други фактори, естественият баланс на въглеродния диоксид и неговото количество в атмосферата е редуциран до такава степен, че днес нивото на въглероден диоксид в атмосферата е 1,5 пъти по-голямо, отколкото преди 200 години. Тъй като въглеродният диоксид е един от най-разпространените парникови газове, се предполага, че това покачване е причина за глобалното затопляне.
Галерия
[редактиране | редактиране на кода]-
Сублимация на сух лед, поставен във вода
-
Фазова диаграма на въглеродния диоксид
-
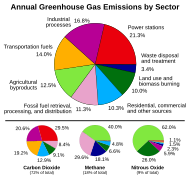
Диаграма на отделения в атмосферата парников газ по тип на сектора
Бележки
[редактиране | редактиране на кода]- ↑ chem.libretexts.org // Посетен на 25 януари 2019 г.
- ↑ В химичната терминология окис е заменено с оксид през 1980-те години; вж Оксид
- ↑ а б в Краус, Лорънс М. Науката за климатичните промени. София, Сиела, 2022. ISBN 9789542841173. с. 200.