Clorato
| ione clorato | |
|---|---|
 | |
| Nome IUPAC | |
| Triossicloro(1-)[1] | |
| Nomi alternativi | |
| clorato(1-) acidanione clorico | |
| Caratteristiche generali | |
| Formula bruta o molecolare | ClO−3 |
| Massa molecolare (u) | 83.447 |
| Numero CAS | |
| PubChem | 104770 |
| SMILES | [O-]Cl(=O)=O |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |

| |
| attenzione | |
| Frasi H | --- |
| Consigli P | --- |
Lo ione clorato (di formula ClO−3) è uno ione del cloro con numero di ossidazione +5. Sono detti clorati i sali dell'acido clorico, che contengono questo ione.
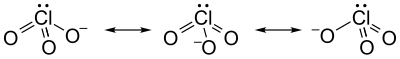
Struttura
[modifica | modifica wikitesto]Si rappresenta comunemente questo ione con la struttura di Lewis (O=)2Cl–O-, con 2 legami doppi (Cl=O) e un legame singolo (Cl–O-), la quale farebbe prevedere due diverse distanze di legame Cl-O. Questa formula è però solo una delle tre forme limite equivalenti che sono tra loro in risonanza[2][3] per questo ione molecolare: questo fa sì che tutti e tre i legami Cl-O e tutti gli angoli OClO siano uguali e che la carica negativa sia anch'essa ugualmente distribuita sui tre atomi di ossigeno.
L'atomo di cloro, dovendo fare 3 legami sigma con gli ossigeni e avendo un doppietto solitario, ha ibridazione sp3, come avviene anche nello ione perclorato ClO−4, il quale ha lo stesso tipo di risonanza. Gli angoli di legame OClO (106°) sono un po' inferiori al valore teorico (angolo tetraedrico, 109,5°) perché il doppietto solitario, come previsto dalla teoria VSEPR, occupa più spazio angolare di un doppietto di legame.[4][5] La forma geometrica dello ione clorato è quindi una priramide trigonale, con il cloro al vertice e i tre ossigeni alla base. Le lunghezze di legame (149 pm nel clorato di potassio[6]) sono appena un po' maggiori che nello ione perclorato (144 pm). Lo ione ha 26 elettroni di valenza ed è precisamente isoelettronico con lo ione solfito (SO32–) e, come questo, ha simmetria (gruppo puntuale) C3v.[7][8]
Proprietà
[modifica | modifica wikitesto]I clorati sono potenti ossidanti (E° ClO3– / Cl– = + 1,45 V in soluzione acida[9]), e contengono una grande quantità di ossigeno. Non a caso sono utilizzati in pirotecnica nella formazione di esplosivi, combinati con altre sostanze combustibili. I clorati di metalli pesanti sono particolarmente instabili, e possono decomporsi in maniera esplosiva per frizione o riscaldamento.
Nella pirotecnica moderna i clorati sono sempre meno diffusi, a favore dei perclorati, più stabili e sicuri.
I clorati
[modifica | modifica wikitesto]- Clorato di alluminio
- Clorato di ammonio
- Clorato di argento
- Clorato di bario
- Clorato di calcio
- Clorato di litio
- Clorato di potassio
- Clorato di sodio
- Clorato di zinco
Note
[modifica | modifica wikitesto]- ^ Nomenclature of Inorganic Chemistry : IUPAC Recommendations 2005 (Red Book), Cambridge, The Royal Society of Chemistry, 2005, p. 315, ISBN 978-0-85404-438-2.
- ^ Gary L. Miessler, Paul J. Fischer e Donald A. Tarr, Inorganic Chemistry, 5ª ed., Pearson, 2014, pp. 46-49, ISBN 0-321-81105-4.
- ^ (EN) Resonance Forms, su Chemistry LibreTexts, 2 ottobre 2013. URL consultato il 27 agosto 2021.
- ^ Gary L. Miessler, Paul J. Fischer e Donald A. Tarr, Inorganic Chemistry, 5ª ed., Pearson, 2014, p. 51, ISBN 0-321-81105-4.
- ^ J.E. Huheey, E.A. Keiter e R.L. Keiter, 6 - La struttura e la reattività delle molecole, in Chimica Inorganica, Seconda edizione italiana, sulla quarta edizione inglese, Piccin Nuova Libraria, Padova, 1999, pp. 209-223, ISBN 88-299-1470-3.
- ^ J. Danielsen, A. Hazell, F. K. Larsen, The structure of potassium chlorate at 77 and 298 K, in Acta Cryst., B37, 1981, pp. 913–915, DOI:10.1107/S0567740881004573.
- ^ Sulfite or sulfate(iv), su community.dur.ac.uk. URL consultato il 27 agosto 2021 (archiviato dall'url originale il 19 gennaio 2022).
- ^ Chlorate anion, su community.dur.ac.uk. URL consultato il 27 agosto 2021 (archiviato dall'url originale il 19 gennaio 2022).
- ^ (DE) Erwin Riedel e Christoph Janiak, Anorganische Chemie, 9ª ed., De Gruyter, 2015, p. 440, ISBN 978-3-11-035526-0.
Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «clorato»
Wikizionario contiene il lemma di dizionario «clorato» Wikimedia Commons contiene immagini o altri file su clorato
Wikimedia Commons contiene immagini o altri file su clorato
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) chlorate, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 32758 · LCCN (EN) sh85024526 · BNF (FR) cb12151748t (data) · J9U (EN, HE) 987007285619905171 |
|---|