Antracè
| Substància química | tipus d'entitat química |
|---|---|
| Massa molecular | 178,078 Da |
| Trobat en el tàxon | |
| Estructura química | |
| Fórmula química | C₁₄H₁₀ |
 | |
| SMILES canònic | |
| Identificador InChI | Model 3D |
| Propietat | |
| Moment dipolar elèctric | 0 D |
| Punt de fusió | 216 °C 215 °C |
| Punt d'ebullició | 339,95 °C (a 101,325 kPa) |
| Moment dipolar elèctric | 0 D |
| NFPA 704: Standard System for the Identification of the Hazards of Materials for Emergency Response () | |
L'antracè o antracé[1] és un hidrocarbur aromàtic policíclic que consta de tres anells de benzè fusionats. És un dels components del quitrà d'hulla. Es fa servir en la producció comercial del tint vermell alazarina i altres tints. L'antracè és incolor però mostra un pic de fluorescència blau sota la llum ultraviolada.
L'any 2010, una forta banda d'absorció d'antracè es va observar en el cúmul obert IC 348, d'estrelles i això podia estar associat a la intervenció d'un núvol molecular.[2]
Producció
[modifica]S'obté comercialment del quitrà d'hulla, les impureses comunes són fenantrenè i carbazol. En laboratori el mètode de la reacció d'Elbs és clàssic per obtenir antracè.
Reaccions
[modifica]L'antracè es fotodimeritza per l'acció de la llum ultraviolada:
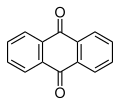
El dímer es converteix en antracè per la calor o amb irradiació ultraviolada per sota de 300 nm. La dimerització reversible i les propietats fotocròmiques són la base de les aplicacions potencials de l'antracè. La reducció de l'antracè generalment dona 9,10-dihidroantracè (destruint l'aromacitat del seu anell central) més que no pas l'1,4-dihidroantracè (que destrueix l'aromacitat d'un dels seus anells terminals). L'oxidació dona antraquinona, C14H₈O₂ (a sota).
Usos
[modifica]L'antracè principalment es converteix en antraquinona, un precursor dels tints.[3]
L'antracè és un semiconductor orgànic. Es fa servir com material que exhibeix luminescència, altrament dit escintil·lador, (scintillator) per a detectors de fotons d'alta eneregia, electrons i partícules alfa. Es pot dopar amb antracè plàstics com el poliviniltoluè per a produir un material plàstic que mostra luminescència usat en la teràpia radiativa. Els pics de l'espectre d'emissió de l'antracè es troben entre 400 nm i 440 nm.
També es fa servir per conservar la fusta, insecticides i material de cobertura.
Derivats
[modifica]Derivats que tenen un grup hidroxil són 1-hidroxiantracè i 2-hidroxiantracè, homòlegs al fenol i naftols, i hidroxiantracè (també anomenat antrol, i antracenol)[4][5] que són farmacològicament actius.
Toxicologia
[modifica]Al contrari que altres hidrocarburs aromàtics, l'antracè no és carcinogen però ha estat inclòs en la llista de substàncies molt preocupants (SVHC) per l'Agència Europea de Productes Químics (ECHA),[6] ja que es considera persistent bioacumulatiu i tòxic (PBT) pels ecosistemes aquàtics.[7]
Referències
[modifica]- ↑ Antracé segons la pronúncia occidental i antracè segons la pronúncia oriental. Per a més informació, consulteu el Llibre d'estil
- ↑ Iglesias-Groth, S.; Manchado, A.; Rebolo, R.; Gonzalez Hernandez, J. I.; Garcia-Hernandez, D. A.; Lambert, D. L.. A search for interstellar anthracene toward the Perseus anomalous microwave emission region, maig 2010.
- ↑ Gerd Collin, Hartmut Höke and Jörg Talbiersky "Anthracene" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim, 2006. doi:10.1002/14356007.a02_343.pub2
- ↑ 1-Hydroxyanthracene NIST datapage
- ↑ 2-Hydroxyanthracene NIST datapage
- ↑ «Candidate List table - ECHA». Arxivat de l'original el 2009-03-18. [Consulta: 21 octubre 2012].
- ↑ «Anthracene». Arxivat de l'original el 2011-06-13. [Consulta: 11 gener 2011].
Enllaços externs
[modifica]- IARC - Monograph 32 Arxivat 2009-11-14 a Wayback Machine.
- National Pollutant Inventory - Polycyclic Aromatic Hydrocarbon Fact Sheet Arxivat 2006-05-18 a Wayback Machine.
- European Chemicals Agency - ECHA Arxivat 2011-01-22 a Wayback Machine.