Adenin
Adenin ist eine der vier Nukleinbasen in DNA und in RNA, neben Cytosin, Guanin und Thymin bzw. Uracil (in RNA).
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
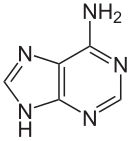
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Adenin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C5H5N5 | |||||||||||||||||||||
| Kurzbeschreibung |
hellgelber Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 135,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Siedepunkt |
Zersetzung ab 360 °C[3] | |||||||||||||||||||||
| Sublimationspunkt | ||||||||||||||||||||||
| Löslichkeit |
schlecht in Wasser (0,5 g·l−1 bei 20 °C)[4] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||||||||
| ΔHf0 | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Es ist eine heterocyclische organische Verbindung mit einem Puringrundgerüst und einer Aminogruppe in 6-Stellung. Das Desoxyadenosin in der DNA und das Adenosin in der RNA sind Nukleoside, die Adenin enthalten. Mit Thymin bzw. Uracil bildet es in der Watson-Crick-Basenpaarung zwei Wasserstoffbrücken.
Darstellung
Bearbeiten- Lord-Todd-Synthese angewandt auf Formamidin und Phenylazomalononitril.
- Adenin kann als Pentamer der Blausäure angesehen werden und in flüssigem Ammoniak mit Ausbeuten von über 20 % aus dieser dargestellt werden.[7]
Geschichte und biologische Bedeutung
BearbeitenAm 12. Januar 1885 berichtete der spätere Nobelpreisträger Albrecht Kossel vor der Berliner Chemischen Gesellschaft über eine bedeutende Entdeckung. Er konnte aus einer größeren Menge Rinder-Bauchspeicheldrüse, die in der Berliner Chemiefabrik Kahlbaum von Adolph Bannow (1844–1919) aufbereitet worden war, eine stickstoffreiche Base mit der Summenformel C5H5N5 isolieren, für die er, abgeleitet von dem griechischen Wort „aden“ für Drüse, den Namen Adenin vorschlug.[8] Kossel wies sie auch als Spaltprodukt des Hefenukleins nach.[9] Er konnte Adenin später auch als Spaltprodukt der Nukleinsäure nachweisen.[10]
Adenin kann Bestandteil der DNA, RNA oder verschiedener Nukleoside und Nukleotide sein.
Nukleoside
BearbeitenÜber das N9-Atom des Fünfringes kann Adenin an das C1-Atom der Ribose N-glycosidisch gebunden werden; man spricht dann von einem Nukleosid, dem Adenosin. Bei der Bindung an Desoxyribose entsteht das Nukleosid Desoxyadenosin. Das synthetische Vidarabin enthält – im Gegensatz zu den meisten Nukleosiden – anstelle der Ribose die Arabinose.
Nukleotide
BearbeitenAn Adenosin kann Phosphorsäure als Phosphatrest gebunden sein, so entstehen
- Adenosinmonophosphat (AMP)
- Cyclisches Adenosinmonophosphat (cAMP)
- Adenosindiphosphat (ADP)
- Adenosintriphosphat (ATP)
Entsprechende Moleküle entstehen, wenn die Phosphatreste an Desoxyadenosin gebunden werden (dAMP; dADP; dATP).
Adenosintriphosphat (ATP) spielt eine besondere Rolle im Energiestoffwechsel der Zelle. Durch die Reaktion ATP → ADP + P wird Energie frei, durch die Reaktion ADP + P → ATP wird Energie chemisch gespeichert.
Cyclisches Adenosinmonophosphat (cAMP) ist ein sehr verbreiteter Second Messenger der zellulären Signaltransduktion.
Adenin ist außerdem Bestandteil des Nicotinamidadenindinucleotids NAD+, das als Coenzym der Wasserstoffübertragung dient und so in der Zelle bei Redox-Reaktionen beteiligt ist. Adenin wird zur Biosynthese des Coenzyms S-Adenosyl-Methionin verwendet, welches bei biologischen Methylierungen Einsatz findet, z. B. durch eine Dam-Methylase.
Bestandteil der DNA und RNA
BearbeitenAdenin bildet in der DNA-Doppelhelix zwei Wasserstoffbrücken mit Thymidin aus. Bei der Transkription dagegen paart sich das Adenin des codogenen Strangs der DNA mit dem Uridin der gerade gebildeten mRNA. In der tRNA gibt es zudem Paarungen mit Dihydrouridin oder Pseudouridin.
| A-T-Basenpaar (DNA) | A-U-Basenpaar (RNA) | A-D-Basenpaar (RNA) | A-Ψ-Basenpaar (RNA) |
Verwandte Verbindungen
Bearbeiten| 1-Methyladenin | 2-Methyladenin | N6-Methyladenin | N6,N6-Dimethyladenin | N6-Isopentenyladenin | 2-Aminopurin (Isoadenin) |
Weblinks
Bearbeiten- Eintrag zu Adenine in der Human Metabolome Database (HMDB), abgerufen am 19. November 2013.
Einzelnachweise
Bearbeiten- ↑ Eintrag zu ADENINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 27. März 2020.
- ↑ Datenblatt Adenin (PDF) bei Carl Roth, abgerufen am 14. Dezember 2010.
- ↑ a b Eintrag zu Adenin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. November 2014.
- ↑ a b c Eintrag zu Adenin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2020. (JavaScript erforderlich)
- ↑ Datenblatt Adenine bei Sigma-Aldrich, abgerufen am 16. Oktober 2016 (PDF).
- ↑ a b W. M. Haynes (Hrsg.): CRC Handbook of Chemistry and Physics. 97. Auflage. (Internet-Version: 2016), CRC Press / Taylor and Francis, Boca Raton FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-3.
- ↑ Albert Gossauer, Struktur und Reaktivitat der Biomoleküle: Eine Einführung in die organische Chemie, Verlag Helvetica Chimica Acta, 2006.
- ↑ Kossel, A.: Über eine neue Base aus dem Thierkörper. Vortrag in: Berichte der Deutschen Chemischen Gesellschaft, Heft 18, 1885, S. 79.
- ↑ Kossel, A.: Weitere Beiträge zur Chemie des Zellkerns. In: Zeitschrift für physiologische Chemie, Band 10, 1886, S. 248.
- ↑ Kossel, A.: Über die chemische Zusammensetzung der Zelle. Vortrag in: Archiv für Anatomie und Physiologie. Physiologische Abteilung, 1891, S. 178.