Cobalt(II)-oxid
Cobalt(II)-oxid ist eines von mehreren Oxiden des chemischen Elementes Cobalt. Es ist ein olivgrünes, in Wasser unlösliches Salz.
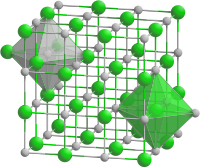
| Kristallstruktur | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||
| _ Co2+ _ O2− | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Cobalt(II)-oxid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Verhältnisformel | CoO | |||||||||||||||
| Kurzbeschreibung |
olivgrüner Feststoff[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 74,93 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
5,7–6,7 g·cm−3[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser (3,13 mg·l−1)[1] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||
Gewinnung und Darstellung
BearbeitenCobalt(II)-oxid entsteht, wenn elementares Cobalt an der Luft oder Cobalt(II)-nitrat, Cobalt(II)-hydroxid oder Cobalt(II)-carbonat unter Luftabschluss erhitzt werden.
Eigenschaften
BearbeitenDie Verbindung kristallisiert in der Natriumchlorid-Struktur, also im kubischen Kristallsystem in der Raumgruppe Fm3m (Raumgruppen-Nr. 225). Der Gitterparameter beträgt a = 424,9 pm, in der Elementarzelle befinden sich vier Formeleinheiten.[4] Meist kommt (ähnlich wie bei Eisen(II)-oxid FeO) ein leichter Cobalt-Unterschuss vor. Trocken ist Cobaltoxid beständig, feucht kann es leicht zu Cobaltoxidhydroxid CoO(OH) oxidiert werden. Unterhalb von 16 °C ist die Verbindung antiferromagnetisch.[5]
Wird es an der Luft auf 400–500 °C erhitzt, bildet sich Cobalt(II,III)-oxid.
Verwendung
BearbeitenCobalt(II)-oxid wird als Rohstoff für die Herstellung von Pigmenten verwendet, insbesondere zur Herstellung des Pigments Smalte, das auch in der Keramikindustrie verwendet wird. Außerdem kann es zur Herstellung von Kobaltglas sowie von Thénards Blau (CoAl2O4) verwendet werden.
Literatur
Bearbeiten- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1.
- N. N. Greenwood, A. Earnshaw: Chemie der Elemente, 1. Auflage, VCH Verlagsgesellschaft, Weinheim 1988, ISBN 3-527-26169-9.
Einzelnachweise
Bearbeiten- ↑ a b c d e f Eintrag zu Cobalt(II)-oxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 3. Januar 2023. (JavaScript erforderlich)
- ↑ Eintrag zu Cobalt oxide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- ↑ G. J. A. Speijers, E. I. Krajnc, J. M. Berkvens, M. J. van Logten: Acute oral toxicity of inorganic cobalt compounds in rats. In: Food and Chemical Toxicology. Band 20, Nr. 3, Juni 1982, S. 311–314, doi:10.1016/S0278-6915(82)80298-6.
- ↑ Jean D’Ans, Ellen Lax: Taschenbuch für Chemiker und Physiker. 3. Elemente, anorganische Verbindungen und Materialien, Minerale, Band 3. 4. Auflage, Springer, 1997, ISBN 978-3-540-60035-0, S. 386 (eingeschränkte Vorschau in der Google-Buchsuche).
- ↑ P. S. Silinsky, M. S. Seehra: Principal magnetic susceptibilities and uniaxial stress experiments in CoO. In: Physical Review B, 24, 1981, S. 419–423; doi:10.1103/PhysRevB.24.419.


