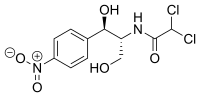
Chloramphenicol
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Chloramphenicol | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C11H12Cl2N2O5 | |||||||||||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[3] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 323,14 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
0,7 g·cm−3[3] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | ||||||||||||||||||||||
Chloramphenicol ist ein Breitbandantibiotikum, das 1947 von John Ehrlich, Paul Rufus Burkholder und weiteren Mitarbeitern[5] entdeckt[6] und im selben Jahr von zwei Forschergruppen unter Paul Rufus Burkholder (1903–1972)[7] und David Gottlieb[8] (1911–1982) aus dem mycelbildenden gram-positiven Bakterium Streptomyces venezuelae gewonnen wurde und sich als hochwirksam gegen Typhus- und Paratyphus-B-Erreger erwiesen hatte.[9] Der primär aus dem „Bodenpilz“ gewonnene Wirkstoff wurde zunächst von dem US-amerikanischen Unternehmen Parke-Davis unter der Bezeichnung bzw. dem Handelsnamen Chloromycetin[10] später auch synthetisch hergestellt und war, begünstigt durch seine relativ einfache Struktur, das erste Antibiotikum, das synthetisch dargestellt werden konnte.[11]
Aufgrund der in seltenen Fällen (≈ 3–17 von 100.000) als Nebenwirkung auftretenden, potentiell lebensbedrohlichen aplastischen Anämie sollte Chloramphenicol heute nur noch nach sorgfältiger Abwägung als Reserveantibiotikum angewendet werden. Obwohl bereits 1985 von der topischen Anwendung abgeraten wurde,[12] ist es in Westeuropa noch immer auch in Augen- und Ohrentropfen, in Augensalben und Hautarzneien zu finden.
Hauptbehandlungsgebiete sind schwere, sonst nicht zu beherrschende Infektionskrankheiten wie Typhus, Paratyphus, Pest, Fleckfieber, Ruhr, Diphtherie und Malaria. Zudem wirkt Chloramphenicol gegen Chytridiomykose, eine für Amphibien tödliche und hoch ansteckende Hautpilzerkrankung, die weltweit Amphibienpopulationen dezimiert.
Chloramphenicol wird heute ausschließlich vollsynthetisch produziert.
Pharmakologie
[Bearbeiten | Quelltext bearbeiten]Chloramphenicol ist ein Translationshemmer, wirkt also blockierend auf die Knüpfung der Peptidbindung, indem es reversibel an das katalytische Zentrum der Peptidyltransferase der 50S-Untereinheit der bakteriellen 70S-Ribosomen bindet und diese hemmt.[13][14] Es ist ein bakteriostatisches Antibiotikum. Hierbei ist es gut gewebegängig, auch durch die Plazenta und in die Muttermilch. Die gute Gewebegängigkeit ist einer der Gründe, warum es in Dermatologie[15] und äußerlich und lokal am Auge als Salbe etwa für Infektionen des Augenlids (z. B. Gerstenkorn) angewandt wird.
Pharmakokinetik
[Bearbeiten | Quelltext bearbeiten]Chloramphenicol wird bei oraler Gabe schnell und vollständig resorbiert. Die Bioverfügbarkeit beträgt bei oraler Verabreichung 80 %, nach intramuskulärer Injektion 70 %. Die Plasmaproteinbindung liegt zwischen 50 % und 60 %. Die Plasmahalbwertszeit beträgt bei Erwachsenen mit normaler Leber- und Nierenfunktion 1,5–3,5 Stunden, bei Kindern und Jugendlichen 3–6,5 Stunden, bei Neugeborenen 24 Stunden oder länger. Die Elimination erfolgt zu 90 % über eine Konjugation an Glucuronsäure. Bei Erwachsenen mit gestörter Nierenfunktion verlängert sich die Plasmahalbwertszeit auf 3–4 Stunden, bei schweren Leberfunktionsstörungen auf 4,6–11,6 Stunden.
Nebenwirkungen und Interaktionen
[Bearbeiten | Quelltext bearbeiten]- Knochenmarksschädigung: dosisabhängig, reversibel – Störung der Erythropoese; dosisunabhängig kann eine irreversible Knochenmarksaplasie (aplastische Anämie) ausgelöst werden, Auftreten hier mit einer Verzögerung von 2–8 Wochen
- Grey-Syndrom
- neurotoxisch
- Kontaktsensibilisierung bei topischer Anwendung
- allergische Reaktionen; anaphylaktische Reaktionen und generalisierte Urtikaria bei systemischer Anwendung
- Herxheimer-Reaktion
- Interaktionen mit oralen Antikoagulatien, Methotrexat, Sulfonylharnstoffen – im Sinne einer Wirkungsverstärkung
- Barbiturate und Phenytoin vermindern die Wirkung von Chloramphenicol
- gleichzeitige Einnahme von oralen Kontrazeptiva kann deren Wirkung beeinträchtigen.
Die Risiken topisch-dermaler Anwendung werden kontrovers beurteilt. Vertreter des Herstellers von Ichtoseptal verweisen darauf, dass ihre Literaturrecherche keinen Anhalt für eine Schädigung der blutbildenden Organe nach topisch-dermaler Anwendung von Chloramphenicol ergab.[16] Kritiker der topisch-dermalen Anwendung verweisen darauf, dass Chloramphenicol grundsätzlich perkutan aufgenommen wird. Die seltene (1:25.000 – 1:50.000), zumeist tödlich verlaufende, dosisunabhängig ausgelöste, irreversible Form der aplastischen Anämie sei auch nach topischer Anwendung, und zwar unabhängig von deren Dauer, beobachtet worden. Selbst Monate nach Absetzen der Medikation könne es zu einer Aplastischen Anämie kommen. Unter allen Medikamenten sei Chloramphenicol der Wirkstoff, der am häufigsten für Aplastische Anämien verantwortlich gemacht wird. Über die wahre Inzidenz hämatologischer Nebenwirkungen ließe sich mangels systematischer, langfristiger Blutbildkontrollen keine Aussage treffen.[17] Es wird vermutet, dass die Ausbildung der medikamenteninduzierten aplastischen Anämie auf die Generierung von Metaboliten mit reaktiven Nitrosogruppen, die die DNA zu schädigen vermögen, zurückzuführen ist.[18][19]
Kontraindikationen
[Bearbeiten | Quelltext bearbeiten]Chloramphenicol ist insbesondere bei Neugeborenen aufgrund der knochenmarksdepressiven Wirkung und geringen therapeutischen Breite kontraindiziert (Grey-Syndrom). Außerdem ist es bei schwerer Leberinsuffizienz, in der Schwangerschaft und der Stillzeit kontraindiziert.
Die Anwendung von Chloramphenicol ist bei Lebensmittel liefernden Tieren gemäß der EU-Rückstandshöchstmengen-Verordnung für Lebensmittel tierischen Ursprungs in der Europäischen Union generell verboten.
Mikrobiologie
[Bearbeiten | Quelltext bearbeiten]Die antibiotische Wirkung von Chloramphenicol wird in der Mikrobiologie genutzt, um bakterielles Wachstum zu inhibieren. Beispielsweise können die meisten Hefen auf einem Malzextrakt-Nährboden mit Chloramphenicol wachsen, bakterielles Wachstum wird jedoch wirkungsvoll gehemmt. Zudem wird Chloramphenicol heute auch für die Verbesserung der FISH (Fluoreszenz-in-situ-Hybridisierung) verwendet, dort wird die Proteinbiosynthese und die den Abbau von rRNA hemmende Wirkung genutzt.
Manche Organismen können durch eine spezifische Acetyltransferase Chloramphenicol inaktivieren, indem sie an den beiden Hydroxygruppen je eine Acetylgruppe einführen. Hierdurch wird das Antibiotikum unwirksam, es bindet nicht mehr an Ribosomen.[20]

Handelsnamen
[Bearbeiten | Quelltext bearbeiten]Halomycetin (A), Kemicetin (A), Posifenicol (D), Septicol (CH) sowie ein Generikum (A)
Aquapred (D), Ichtoseptal (D), Sperdex comp. (CH)[21][22][23]
Chloro-Sleecol, Chloromycetin, Otiprin N, Prurivet S
Literatur
[Bearbeiten | Quelltext bearbeiten]- Alfred Marchionini, Hans Götz: Neuere Erfahrungen mit der antibiotischen Behandlung der Hautkrankheiten (Aureomycin, Chloromycetin, Terramycin). In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. 71–74, insbesondere S. 71 und 73.
Zur Häufigkeit des Auftretens von aplastischer Anämie:
- K. Hausmann, G. Skrandies: Aplastic Anemia following chloramphenicol therapy in Hamburg and surrounding districts. In: Postgrad Med J. Band 50 (Supplement), 1974, S. 131–136.
- K. Hausmann, G. Skrandies, P. Sachtleben: Aktuelle Aspekte arzneimittelbedingter Knochenmarkschäden. In: Münchener Medizinische Wochenschrift. Band 116, 1974, S. 1621–1626.
Einzelnachweise
[Bearbeiten | Quelltext bearbeiten]- ↑ Neue Präparate: Leukomycin. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. XXIV.
- ↑ Neue Präparate: Leukomycin. In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. XXIV.
- ↑ a b c d e f Eintrag zu Chloramphenicol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 2. Januar 2024. (JavaScript erforderlich)
- ↑ a b c Eintrag zu Chloramphenicol. In: Römpp Online. Georg Thieme Verlag, abgerufen am 30. Mai 2014.
- ↑ John Ehrlich, Quentin R. Bartz, Robert M. Smith, Dwight A. Joslyn, and Paul R. Burkholder: Chloromycetin, a New Antibiotic From a Soil Actinomycete. In: Science. Band 106, 1947, Nr. 2757, S. 417; doi:10.1126/science.106.2757.417, PMID 17737966.
- ↑ Alfred Marchionini, Hans Götz: Neuere Erfahrungen mit der antibiotischen Behandlung der Hautkrankheiten (Aureomycin, Chloromycetin, Terramycin). In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. 71–74, hier: S. 73.
- ↑ National Academy of Sciences: Paul Rufus Burkholder, 1903–1972, A Biographical Memoir by James G. Horsfall.
- ↑ Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 51–52.
- ↑ Paul Diepgen, Heinz Goerke: Aschoff/Diepgen/Goerke: Kurze Übersichtstabelle zur Geschichte der Medizin. 7., neubearbeitete Auflage. Springer, Berlin/Göttingen/Heidelberg 1960, S. 65.
- ↑ Karl Wurm, A. M. Walter: Infektionskrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 9–223, hier: S. 51.
- ↑ Alfred Marchionini, Hans Götz: Neuere Erfahrungen mit der antibiotischen Behandlung der Hautkrankheiten (Aureomycin, Chloromycetin, Terramycin). In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. 71–74, hier: S. 71 und 73.
- ↑ H. Kiffe, H. Ippen: Systemische Nebenwirkungen durch äußerliche Anwendung von Chloramphenicol. In: Der Hautarzt. 36, Springer-Verlag 1985, S. 181–183.
- ↑ Birte Vester, Andrea T. Feßler, Geovana Brenner Michael, Yang Wang, Kristina Kadlec: Lincosamides, Streptogramins, Phenicols, and Pleuromutilins: Mode of Action and Mechanisms of Resistance. In: Cold Spring Harbor Perspectives in Medicine. Band 6, Nr. 11, 1. November 2016, S. a027037, doi:10.1101/cshperspect.a027037, PMID 27549310, PMC 5088508 (freier Volltext) – (englisch).
- ↑ Amanda Y. Shen, Elie J. Haddad, David J. Hunter‐Smith, Warren M. Rozen: Efficacy and adverse effects of topical chloramphenicol ointment use for surgical wounds: a systematic review. In: ANZ Journal of Surgery. Band 88, Nr. 12, 2018, S. 1243–1246, doi:10.1111/ans.14465 (englisch).
- ↑ Vgl. Alfred Marchionini, Hans Götz: Neuere Erfahrungen mit der antibiotischen Behandlung der Hautkrankheiten (Aureomycin, Chloromycetin, Terramycin). In: Münchener Medizinische Wochenschrift. Band 95, Nr. 1, 2. Januar 1953, S. 71–74.
- ↑ J. Warnecke, W. Fehrs (Ichthyol-Gesellschaft Hamburg): Stellungnahme zur Arbeit von P. H. Höger: „Topische Antibiotika und Antiseptika“; Hautarzt (1998) 49:331–347. In: Der Hautarzt. 12, 1998, Springer-Verlag, 1998, S. 938. doi:10.1007/s001050050853.
- ↑ P. H. Höger: Stellungnahme des Autors. In: Der Hautarzt. 12, 98, Springer-Verlag 1998, S. 939.
- ↑ Shiho Ohnishi, Mariko Murata, Naoyuki Ida, Shinji Oikawa, Shosuke Kawanishi: Oxidative DNA damage induced by metabolites of chloramphenicol, an antibiotic drug. In: Free Radical Research. Band 49, Nr. 9, Juli 2015, doi:10.3109/10715762.2015.1050963, PMID 25971446 (englisch).
- ↑ J. A. Turon, C. M. Andrews, A. C. Havard, T. C. Williams: Studies on the haemotoxicity of chloramphenicol succinate in the Dunkin Hartley guinea pig. In: International Journal of Experimental Pathology. Band 53, Nr. 5, PMID 12641819 (englisch).
- ↑ Theodor Dingermann, Rudolf Hänsel, Ilse Zündorf (Hrsg.): Pharmazeutische Biologie: Molekulare Grundlagen und klinische Anwendungen. 1. Auflage. Springer Verlag, Berlin 2002, ISBN 3-540-42844-5, S. 301.
- ↑ Rote Liste Online, Stand: August 2009.
- ↑ AM-Komp. d. Schweiz, Stand: August 2009.
- ↑ AGES-PharmMed, Stand: August 2009.