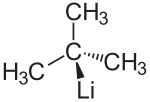
tert-Butyllithium
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | tert-Butyllithium | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C4H9Li | ||||||||||||||||||
| Kurzbeschreibung |
farbloser, pyrophorer Feststoff[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 64,05 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Schmelzpunkt |
140 °C (Zersetzung)[2] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen (0 °C, 1000 hPa). | |||||||||||||||||||
tert-Butyllithium (t-BuLi) ist eine tertiäre metallorganische Verbindung des Elements Lithium (Organolithium-Verbindung). Daneben gibt es noch die isomeren Formen n-Butyllithium und sec-Butyllithium. Die Basizität nimmt in der Reihe n-Butyllithium < sec-Butyllithium < tert-Butyllithium zu. t-BuLi ist somit die stärkste Base in dieser Reihe.
Darstellung
[Bearbeiten | Quelltext bearbeiten]Die Synthese kann durch Reaktion von t-Butylchlorid mit Lithium in Form einer Lithium-Natrium-Legierung erfolgen.[4]
Eigenschaften
[Bearbeiten | Quelltext bearbeiten]Im Handel ist es ausschließlich als Lösung in Alkanen (zumeist in Pentan oder Heptan) erhältlich, wobei eine Konzentration von 1,7 mol/l üblich ist. Ether wie THF oder Diethylether sind als Lösemittel zur Lagerung ungeeignet, da sie rasch zersetzt werden.[5]
Reaktionen
[Bearbeiten | Quelltext bearbeiten]Die Lithium-Kohlenstoff-Bindung im tert-Butyllithiummolekül ist stark polarisiert. Das Kohlenstoffatom trägt dabei eine negative und das Lithiumatom eine positive Partialladung. tert-Butyllithium verhält sich daher chemisch ähnlich wie ein entsprechendes Carbanion. Durch Formulierung einer mesomeren Grenzstruktur lässt sich dieses Verhalten veranschaulichen:[6]
Ähnlich wie n-Butyllithium kann auch t-BuLi für den Lithium-Halogenaustausch und zum Deprotonieren von Aminen und aktivierten C-H-Verbindungen verwendet werden. t-BuLi kann zudem die Alpha-Position der Ether angreifen. In Diethylether beträgt die Halbwertszeit von t-BuLi bei 0 °C etwa 60 Minuten. Im Falle von Tetrahydrofuran sind es gar nur 40 min bei −20 °C.[7] Bei Raumtemperatur wird THF innerhalb von Minuten zersetzt:
Diese Methode wird zum Beispiel benutzt, wenn deprotonierter Acetaldehyd benötigt wird.[4]
Um Nebenreaktionen mit dem Lösungsmittel zu vermeiden, können Reaktionen mit t-BuLi bei niedrigen Temperaturen unter Verwendung von Lösungsmittelgemischen wie der Trapp-Mischung aus THF, Diethylether und Pentan durchgeführt werden, welche dann noch flüssig sind.[4]
Verwendung
[Bearbeiten | Quelltext bearbeiten]t-BuLi hat in der modernen synthetischen organischen Chemie Bedeutung als ultrastarke Base beziehungsweise als Lithiierungsreagenz erlangt. So reagiert es selbst mit sehr schwachen Säuren. Daneben eignet es sich sowohl für heteroatom-dirigierte Lithiierungen als auch für Halogen-Lithium-Austauschreaktionen.[4]
Sicherheitshinweise
[Bearbeiten | Quelltext bearbeiten]t-BuLi kann in Lithiumhydrid und Isobuten zerfallen, insbesondere über 140 °C. Es ist auch in Lösung äußerst pyrophor und verbrennt an der Luft mit einer typisch violetten Flamme. Außerdem reagiert es heftig mit Wasser und anderen protischen Lösungsmitteln.[4]
Die Lösungsmittel, in denen tert-Butyllithium aufbewahrt wird, sind selbst hoch entzündlich. Arbeiten mit Lösungen von t-BuLi führen immer wieder zu schweren Laborunfällen. 2008 starb eine Mitarbeiterin der University of California, Los Angeles an schweren Verbrennungen. Der Kolben der verwendeten Plastikspritze hatte sich gelöst, woraufhin sich die an Luft und Kleidung verteilte Chemikalie entzündete.[8][9]
Quellen
[Bearbeiten | Quelltext bearbeiten]- ↑ Eintrag zu Butyllithium. In: Römpp Online. Georg Thieme Verlag, abgerufen am 24. Mai 2014.
- ↑ a b Ulrich Wietelmann, Richard Bauer: Lithium and Lithium Compounds. In: Ullmann's Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2005, doi:10.1002/14356007.a15_393.
- ↑ a b Datenblatt tert-Butyllithium, nominally 1.5M in n-pentane, packaged under Argon in resealable ChemSeal bottles bei Alfa Aesar, abgerufen am 27. September 2018 (Seite nicht mehr abrufbar).
- ↑ a b c d e William F. Bailey, Nanette Wachter-Jurcsak: t -Butyllithium. In: Encyclopedia of Reagents for Organic Synthesis. John Wiley & Sons, Ltd, Chichester, UK 2009, ISBN 978-0-471-93623-7, doi:10.1002/047084289x.rb396.pub2.
- ↑ Elschenbroich, C. (2006). Organometallics. Weinheim: Wiley-VCH. ISBN 978-3-527-29390-2.
- ↑ K. P. C. Vollhardt, N. E. Schore: Organische Chemie. 3. Auflage. Wiley-VCH, 2005, ISBN 978-3-527-29819-8.
- ↑ tanetty, P; Koller, H.; Mihovilovic, M. (1992). "Directed ortho Lithiation of Phenylcarbamic acid 1,1-Dimethylethyl Ester (N-BOC-aniline). Revision and Improvements". Journal of Organic Chemistry. 57 (25): 6833–6837. doi:10.1021/jo00051a030
- ↑ Kate Allen: A young lab worker, a professor and a deadly accident. In: Toronto Star. 30. März 2014, abgerufen am 14. Januar 2023 (englisch).
- ↑ Kim Christensen: Deadly UCLA lab fire leaves haunting questions. In: Los Angeles Times. 1. März 2009, abgerufen am 14. Januar 2023 (englisch).







