Asetoni
| Asetoni | |
|---|---|
 |
|
 |
|
| Tunnisteet | |
| Muut nimet | 2-propanoni, dimetyyliketoni |
| CAS-numero | |
| PubChem CID | |
| SMILES | CC(=O)C |
| Ominaisuudet | |
| Molekyylikaava | C3H6O |
| Moolimassa | 58,09 g/mol |
| Ulkomuoto | Väritön neste |
| Sulamispiste | −94,9 °C (178,2 K) |
| Kiehumispiste | 56,3 °C (329,4 K) |
| Tiheys | 0,79 g/cm3 |
| Liukoisuus veteen |
Täysin liukeneva veteen Liukenee etanoliin, metanoliin, bentseeniin ja kloroformiin |
Asetoni (myös 2-propanoni, propanoni, dimetyyliketoni, kemiallinen kaava C3H6O) on yksinkertaisin ketoniyhdiste. Asetoni on normaaliolosuhteissa väritön ja helposti syttyvä tunnusomaisen hajun omaava neste[1]. Orgaanisena yhdisteenä se liukenee eetteriin, mutta pienen kokonsa ja ketoniryhmän ansiosta myös veteen ja etanoliin. Asetoni haihtuu erittäin nopeasti. Sen leimahduspiste on -18 °C ja itsesyttymislämpötila 465 °C.
Asetoni on erittäin heikko happo ja sen happovakion kymmenkantainen negatiivinen logaritmi pKa=19,3. Happamuus johtuu resonanssin stabiloimasta konjugaattiemäksestä.[2] Toisessa resonanssimuodossa elektronegatiivinen happiatomi stabiloi negatiivisen varauksen.


Käyttö
[muokkaa | muokkaa wikitekstiä]Asetonia käytetään lähinnä liuottimena ja yleisesti orgaanisissa synteeseissä sekä laboratoriokemikaalina. Sitä valmistetaan hapettamalla 2-propanolista. Asetonia on muun muassa kynsilakanpoistoaineessa ja tinnerissä.
Valmistus
[muokkaa | muokkaa wikitekstiä]Asetonia on aiemmin tuotettu asetaattien kuivatislauksella. Ensimmäisen maailmansodan aikana sitä alettiin tuottaa Britanniassa teollisesti asetoni-butanoli-etanoli-käymisen avulla (ABE), jota jo Louis Pasteur ja F. Schardinger olivat käyttäneet, maissin ja hevoskastanjoiden tärkkelyksestä[3] Chaim Weizmannin eristettyä Clostridium acetobutylicum -bakteerin.
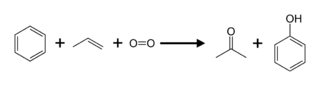
Nykyisin asetonia tuotetaan pääasiassa propeenista. Pääasiallinen valmistusmenetelmä on kumeeniprosessi, jossa ensin tuotetaan bentseeniä propeenilla alkyloimalla kumeenia (isopropyylibentseeni). Kumeeni hapetetaan hapen avulla kumeenihydroperoksidiksi, joka taas hajotetaan niin sanotulla Hock-toisiintumisella happamissa olosuhteissa asetoniksi ja fenoliksi.

Ketoosissa ihmisen elimistö tuottaa asetonia. Asetonin haju on yksi ketoosin tuntomerkeistä.
Terveysvaarat
[muokkaa | muokkaa wikitekstiä]Asetoni ärsyttää silmiä, ihoa ja hengitysteitä. Suuret asetonipitoisuudet voivat aiheuttaa nenän, nielun ärsytystä ja silmien kirvelyä ja erittäin suuret pitoisuudet heikkoutta, päänsärkyä, väsymystä, pahoinvointia ja mahdollisesti jopa tajuttomuuden ja kuoleman. Mikäli asetonia menee silmään, se voi aiheuttaa sidekalvontulehduksen tai jopa sarveiskalvon vaurion. Asetonin joutuessa iholle, iho kuivuu. Muutaman desilitran nielemisestä aiheutuu tajuttomuus. On todettu, että päivittäinen asetonihöyryn suurille pitoisuuksille altistuminen aiheuttaa pohjukaissuolen, mahalaukun ja hengitysteiden tulehdusta.
Lähteet
[muokkaa | muokkaa wikitekstiä]- ↑ https://www.ilo.org/dyn/icsc/showcard.display?p_card_id=0087&p_version=1&p_lang=fi
- ↑ John McMurry: Organic Chemistry (5th edition), s. 77. Brooks/Cole, 2000. ISBN 0-534-37366-6 (englanniksi)
- ↑ http://www.bigsiteofamazingfacts.com/how-were-chestnuts-used-to-produce-cordite-powder-in-ammunition-during-world-war-i
Aiheesta muualla
[muokkaa | muokkaa wikitekstiä]- Asetonin käyttöturvallisuustiedote, Sigma Aldrich, viitattu 26.12.2014.
- Asetonin kansainvälinen kemikaalikortti
- Asetonin OVA-ohje (Arkistoitu – Internet Archive)
- Kemian työsuojeluneuvottelukunta (KETSU): Asetoni (Arkistoitu – Internet Archive)
- PubChem: Acetone (englanniksi)
- Human Metabolome Database: Acetone (englanniksi)
- KEGG: Acetone (englanniksi)
- ChemBlink: Acetone (englanniksi)