Réaction de Blaise
La réaction de Blaise est une réaction organique de couplage qui permet de former un β-cétoester à partir de zinc métallique, d'un α-bromoester et d'un nitrile[1],[2],[3]. La réaction a été publiée pour la première fois par Edmond Blaise en 1901.
Présentation synthétique
[modifier | modifier le code]Au cours de cette synthèse, une métaloimine intermédiaire est formée, puis hydrolysée pour donner le β-cétoester souhaité[4].
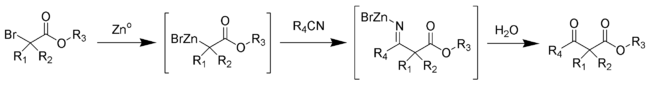
Les esters aliphatiques encombrés donnent en général des rendements plus élevés.
Dans cette réaction, des groupements hydroxyles libres sont tolérés[5],[6], ce qui est rare lors de réactions faisant intervenir des organométalliques dérivés d'halogénures.
Mécanisme détaillé
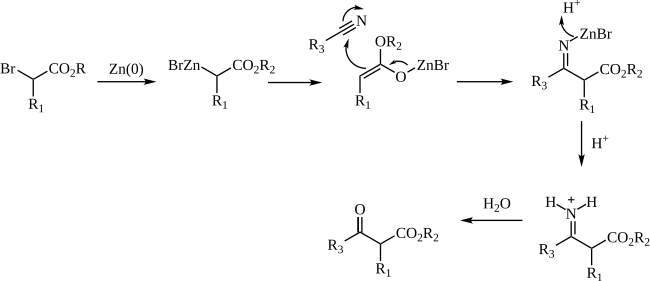
[modifier | modifier le code]Le mécanisme de la réaction de Blaise passe par la formation d'un organozincique complexe avec le brome en α du carbonyle de l'ester. Cela rend le carbone en α nucléophile, permettant une attaque électrophile du carbone du nitrile. L'azote alors chargé négativement du nitrile interagit avec le monobromure de zinc cationique. Le β-ènaminoester (tautomère de l'imine intermédiaire sur le schéma ci-dessus) est isolé lors d'un traitement du milieu réactionnel par une solution aqueuse à 50 % de K2CO3. Si le β-cétoester est le produit désiré, l'addition d'acide chlorhydrique molaire permet l'hydrolyse du β-ènaminoester en β-cétoester.
Notes et références
[modifier | modifier le code]Voir aussi
[modifier | modifier le code]Bibliographie
[modifier | modifier le code]- Edmond Blaise, « Nouvelles réactions des dérivés organométalliques (II) : Éthers α-alcoyl-β-cétoniques », Comptes rendus hebdomadaires des séances de l'Académie des sciences, vol. 132, , p. 478 (lire en ligne).
- (en) Kenneth L. Rinehart, Jr., « sec-Butyl a-n-Caproylpropionate [Octanoic Acid, 2-methyl-3-Oxo, sec-butyl Ester] », Organic Syntheses, coll. vol. 4, 1963, p. 120 ; vol. 35, 1955, p. 15 (lire en ligne, consulté le ).
- (en) H. Surya Prakash Rao, Shaik Rafi et K. Padmavathy, « The Blaise Reaction », Tetrahedron, vol. 64, , p. 8037-8043.
- (en) James Cason, Kenneth L. Rinehart, Jr. et Stephen D. Thornton, Jr., « The Preparation of β-Keto Esters from Nitriles and α-Bromoesters », The Journal of Organic Chemistry, vol. 18, , p. 1594 (DOI 10.1021/jo50017a022).
- (en) Steven M. Hannick et Yoshito Kishi, « An Improved Procedure for the Blaise Reaction : A Short, Practical Route to the Key Intermediates of the Saxitoxin Synthesis », J. Org. Chem., vol. 48, , p. 3833 (DOI 10.1021/jo00169a053).
- (en) Jiří Pospíšil et István E. Markó, « Total Synthesis of Jerangolid D », Journal of the American Chemical Society, ASAP, (DOI 10.1021/ja0691728).
- (en) Fang-Dao Wang et Jian-Min Yue, « Total Synthesis of (R)-(+)-Kavain via (MeCN)2PdCl2-Catalyzed Isomerization of a cis Double Bond and Sonochemical Blaise Reaction », Synlett, vol. 13, , p. 2077-2079 (DOI 10.1055/s-2005-871953).
Article connexe
[modifier | modifier le code]Lien externe
[modifier | modifier le code]- « Blaise Réaction », sur Organic Chemistry Portal, développe le sujet et donne une bibliographie des publications récentes.