Միոտոնիկ դիստրոֆիա
| Միոտոնիկ դիստրոֆիա | |
|---|---|
| Տեսակ | հազվագյուտ հիվանդություն և հիվանդության կարգ |
| Պատճառ | Մուտացիա[1] |
| Հիվանդության ախտանշաններ | Մկանաթուլություն[1], շնչառական անբավարարություն[1], muscle atrophy?[1], Ոսպնյակի մթագնում[1], առիթմիա[1], Դիսֆագիա[1], կարդիոմիոպաթիա[1] և sterility?[1] |
| Բուժաքննություն | գենետիկ թեստ[1], Տեսողության օրգանի հետազոտություն[1] և Էլեկտրոնագրաֆիա[1] |
| Բժշկական մասնագիտություն | նյարդաբանություն |
| Բուժում | mechanical ventilation?[2], Սնուցման զոնդ[2] և artificial pacemaker?[1] |
Միոտոնիկ դիստրոֆիա երկարատև գենետիկական խանգարում է, որն ազդեցություն է թողնում մկանային գործառույթների վրա[3]։ Ախտանիշները ներառում են մկանաին զանգվածի աստիճանական կորուստ և թուլություն[3]։ Մկանները հաճախ կծկվում են և չեն կարողանում թուլանալ[3]։ Ախտանիշներից հաճախ կարող են հանդիպել կատարակտան, մտավոր հետամնացությունը, սրտային հաղորդականության խնդիրները[3][4]։ Տղամարդկանց մոտ կարող է ի հայտ գալ վաղ ճաղատություն և անպտղություն[3]։
Միոտոնիկ դիստրոֆիան աուտոսոմ դոմինանտ խանգարում է, որը սովորաբար ժառանգվում է ծնողներից[3]։ Գոյություն ունի երկու հիմնական տիպ։ Տիպ 1․ (ՄԴ1) DMPK գենի մուտացիայի հետևանքով և տիպ 2․ (ՄԴ2) CNBP գենի մուտացիայի հետևանքով[3]։ Խանգարումը կարող է զարգանալ ցանկացած տարիքում։ ՄԴ1 տիպը կարող է ակնհայտ դառնալ ծնվելիս[3]։ ՄԴ2 տիպը մեղմ է ընթանում[3]։ Կան միոտոնիկ դիստրոֆիայի տեսակներ[3]։ Ախտորոշումը հաստատվում է գենետիկական թեստավորման միջոցով[4]։
Բուժում գոյություն չունի[5]։ Բուժման միջոցառումները կարող են ներառել ձգումները, հաշմանդամի սայլակը, կարդիոստիմուլյատորները[4]։ Երբեմն Մեքսիլեթին և Կարբամազեպին պրեպարատները կարող են օգտակար լինել։ Սուր ցավը կարող է բուժվել եռցիկլիկ հակադեպրեսանտներով կամ ոչ ստերոիդային հակաբորբոքայիններով[4]։
Ամբողջ աշխարհում 8000 անձից մեկից ավելին ունի միոտոնիկ դիստրոֆիա[3]։ Միոտոնիկ դիստրոֆիան կարող է զարգանալ ցանկացած տարիքում, սակայն սովորաբար սկսվում է 20-30 տարեկանում[3]։ Այն ամենատարածված միոտոնիկ դիսրոֆիան է, որը զարգանում է հասուն տարիքում[3]։ Առաջին անգամ նկարագրվել է 1909 թվականին, իսկ տիպ 1-ի զարգացման հիմնական պատճառը բացահայտվել է 1992-ին[4]։
Նշաններ և ախտանիշներ
[խմբագրել | խմբագրել կոդը]Ախտանիշներն ու նշանները փոփխական են, պայմանավորած ձևով (ՄԴ1/ՄԴ2), ծանրությամբ և ՄԴ2 անսովոր ֆենոտիպերով։ ՄԴ1-ի սիմպտոմները ՄԴ2-ի համար ներառում են խնդիրներ կատարողական գործառույթների հետ (Կազմակերպում, կոնցենտրացում, խոսքի որոնում) և հիպերսոմնիա։ Հաղորդականության խանգարումները ավելի հաճախ հանիդում են ՄԴ1 տիպի դեպքում, սակայն բոլոր հիվանդներին խորհուրդ է տրվում տարին մեկ անգամ կատարել ԷՍԳ։ Երկու տեսակն էլ ասոցացվում են ինսուլինառեզիստենտականության հետ։ Միոտոնիկ դիստրոֆիայի դեպքում կարող է առաջանալ կեղևայի կատարակտա կամ հետին ենթապատիճային կատարակտա[6]։
DM2-ն ավելի մեղմ է, քան DM1- ը, որպես կանոն DM2-ով մարդիկ ավելի քիչ օժանդակ սարքերի կարիք ունեն, քան DM1-ով մարդիկ[փա՞ստ]։ Բացի այդ CD-ի դեպքում հանդիպող բնածին ծանր ձևերը CD2-ի դեպքում չեն նկարագրվում և բժշկական գրականության մեջ երիտասարդների մոտ վաղ ախտանիշների հայտնաբերումը հազվադեպ է նկարագրված։
Ախտանիշները կարող են ի հայտ գալ ցանկացած տարիքում՝ նորածնային հասակից մինչ հասուն տարիք։ ՄԴ առաջացնում է ընդհանուր թուլություն, որը սկսվում է ձեռքերի, ոտքերի, պարանոցի, կամ դեմքի մկաններից։ Այն դանդաղորեն պրոգրեսիվում է, ներառելով այլ մկանային խմբեր, ներառյալ սրտամկանը։ ՄԴ ախտահարում է այլ օրգան-համակարգերի լայն շրջանակ։
Գենետիկա
[խմբագրել | խմբագրել կոդը]
Միոտոնիկ դիտրոֆիան գենետիկական վիճակ է, որը ժառանգվում է աուտոսով դոմինանտ կերպով։ Այսպիսով կրողները փոխանցում են իրենց սերունդների 50%-ին։ Մկանային դիստրոֆիան համարվում է եռնուկլեոտիդային հաջորդականության խախտման հայտնի ձևերից մեկը։ ԴՆԹ-ի որաշակի հատվածներ ունեն կրկնվող հաջորդականություններ՝ կազմված երեք կամ չորս նուկլեոտիդներից[փա՞ստ]։
Մկանային դիստրոֆիան ժառանգական հիվանդություն է։ Ծանր ձևը՝ բնածին միոտոնիկ դիստրոֆիան, կարող է դրսևորվել այն նորածինների մոտ, որոնց մայրերն ունեն ՄԴ։ Բնածին միոտոնիկ դիստրոֆիան կարող է ժառանգվել հայրական կողմից, չնայած այն հարաբերականորեն հազվադեպ է հանդիպում։
ՄԴ1
[խմբագրել | խմբագրել կոդը]ՄԴ1-ի դեպքում ախտահարված գենը կոչվում է DMPK, որով կոդավորվում է մկանային դիստրոֆիայի պրոտեին կինազան[7], Սպիտակուցը առավելապես էքսպրեսվում է կմախքային մկաններում[8]։ Գենը տեղակայված է 19րդ քրոմոսոմի երկար թևի վրա[9][10]։
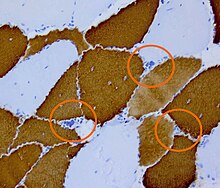
ՄԴ1-ի դեպքում DMPK գենում տեղի է ունենում ցիտոզին-թիմին-գուանին (ՑԹԳ) տրիպլետային հաջորդականության երկարում։ 5-37 կրկնությունները համարվում են նորմա, մինչ դեռ 38-49 կրկնությունը համարվում է պրեմուտացիա և կա ռիսկ, որ այդ անհատները հետագայում կունենան սիմպտոմատիկ հիվանդությամբ երեխաներ[11]։
50-ից ավել կրկնություններով անհատները գրեթե անխուսափելիորեն սիմպտոմատիկ են, որոշակի բացառություններով։ Ավելի երկար կրկնությունները կապվում են վաղ սկզբի և ծանր ընթացքի հետ[փա՞ստ]։
DMPK-ի ավելի քան 37 կրկնություն պարունակող ալելները համարվում են ոչ ստաբիլ, և հավելյալ տրիպլետների ներդրումը կարող է լինել բջջի բաժանման ժամանակ՝ միտոզի կամ մեյոզի։ Հետևաբար պրեմուտացիա կամ մուտացիա ունեցող երեխաները ժառանգում են ԴՄՊԿ ալել, որն ավելի երկար է, քան իրենց ծնողներինը։ Այդ պատճառով էլ նրանք ունեն ախտահարվելու կամ ավելի վաղ սկզբի ու ծանր ընթացքի ավելի մեծ հավանականություն։ Այս երևույթը հայտնի է որպես անտիտիպատիա։
Կրկնության ընդլայնումը սովորաբար տեղի է ունենում ԴՆԹ-ի ռեպարացիայի կամ կրկնապատման ընթացում[12]։ Հոմոլոգիական ռեկոմբինատ ռեպարացիայի, կրկնակի շղթայի քանդման ռեպարացիայի կամ ԴՆԹ- ի այլ ռեպարատիվ պրոցեսսների ընթացքում առաջացած անհամապատասխանությունները նպաստում են եռնուկլեոտիդային կրկնության ընդլայմանը[12]։ Բնածին ձևի հայրական փոխանցումը հազվադեպ է հանդիպում (13%), սակայն յուվենիլ կամ հասուն ձևը հավասարապես փոխանցվում է երկու ծնողական կողմից։ Անտիտիպատիան պակաս ծանր է քան մայրական ժառանգման ժամանակ։
Ընդլայնված եռնուկլեոտիդային կրկնությունների հատվածի ՌՆԹ-ն կազմում է ներնուկլեոպլազմատիկ հանգույց, շնորհիվ Ց-Գ հիմքերի միջև առկա ծավալուն ջրածնային կապերի, և դա ցույց է տալիս այդ հատվածի կապման կարգավորիչ MBNL1-ին կառուցել տարբերակիչ կետը[13]։
ՄԴ2
[խմբագրել | խմբագրել կոդը]ՄԴ2 առաջանում է 3րդ քրոմոսոմում CNBP գենի դեֆեկտի հետևանքով[14]։ Յուրահատուկ դեֆեկտ է համարվում CNBP գենում ցիտոզին-ցիտոզին-թիմին-գուանին տետրանուկլեոտիդի կրկնությունը[14]։ Քանի որ այն ներառում է չորս նուկլեոտիդի կրկնություն, համարվում է տետրանուկլեոտիդային հաջորդականության կրկնության խանգարում, այլ ոչ թե տրինուկլեոտիդային[15][16]։
Կրկնության ընդլայնումը ՄԴ2-ի համար ավելի մեծ է քան ՄԴ1-ի համար (մոտ 75-ից մինչև 100 հազար և ավելի կրկնություն)[14]։ ԴՄ2ի դեպքում կրկնություն ընդլայնման չափը կապված չէ հիվանդության սկզբի և ծանրության հետ[11]։
Ախտորոշում
[խմբագրել | խմբագրել կոդը]ՄԴ1-Ի և ՄԴ2-Ի ախտորոշում կարող է դժվարություններ առաջացնել կախված այն բանի հետ, որ գոյություն ունեն բազմաթիվ նյարդամկանային խանգարումներ, որոնցից շատերը հազվադեպ են հանդիպում։ Գոյություն ունի մոտ 100 տարբերակներով շուրջ 40 նյարդամկանային խանգարումներ[փա՞ստ]։
Արդյունքում այն մարդիկ ովքեր ունեն այնպիսի ախտանիշներ, որոնք կարող են բացատրվել ՄԴ1-Ի կամ ՄԴ2-Ի առկայությամբ, ախտորոշման նպատակով ուղարկվում են նյարդաբանի մոտ։ Կախված ախտանիշների դրսևորմից հիվանդները կարող են ուղղորդվել տարբեր մասնագետների ( սրտաբան, ակնաբույժ, էնդոկրինոլոգ, ռևմատոլոգ) մոտ։ Կլինիկական նշանները կարող են քողարկված լինել կապված ծանրության աստիճանի և անսովոր ֆենոտիպերի հետ։
Այժմ ՄԴ-ի համար բուժում չկա և հիմնական բուժումը սիմպտոմատիկ է, այնուամենայնիվ հստակ ախտորոշումն անհրաժեշտ է այլ հնարավոր խնդիրները կանխարգելելու համար (օրինակ կատարակտան)։ Հստակ ախտորոշումն անհրաժեշտ է համապատասխան բժշկական մոնիթորինգի և ախտանիշները հսկելու համար։ Բացի այդ, բարձր փոխանցման ռիսկի պատճառով գենետիկական խորհրդատվությունը պետք է հասանելի լինի բոլորի համար։
Դասակարգում
[խմբագրել | խմբագրել կոդը]| Տիպ | Գեն | Կրկնություն | Անտիտիպատիա | Ծանրություն |
|---|---|---|---|---|
| ԴՄ1 | DMPK | CTG | կա | միջին ծանրության |
| ԴՄ2 | ZNF9 | CCTG | մինիմալ/չկա | թեթև միջին |
Գոյություն ունի 2 հիմնական տիպ:Տիպ 1 (ՄԴ1), հայտնի է որպես Ստեինտերտի հիվանդություն, ունի ծանր բնածին ձև նաև մանկական տարիքում սկսվող ավելի թեթև և հասուն տարիքային ձև[17]։ Այն հիմանակնում ախտահարում է դեմքի մկանները, վերին կոպը բարձրացնող մկանը, քունքային, կրծոսկրաանրակապտկաձևային մկանները, նախաբազկի հեռակա մկանները, սրունքթաթային հոդի դորզոֆլեքսորները[18]։ Տիպ 2 (ՄԴ2) հայտնի է որպես մոտակա միոտոնիկ միոպաթիա, ավելի հազվադեպ է հանդիպում և դրսևերվում է ավելի թեթև նշաններով ու ախտանիշներով:[փա՞ստ]։
ՄԴ1 կամ ՄԴ2 գենետիկական մուտացիաների հետ ասոցացված այլ տիպի միոտոնիկ դիստրոֆիայի ձևեր չեն նկարագրված[11]։ ՄԴ3 անվանմանը հավակնող դեպքերից մեկը[19] հետագայում բնորոշվեց որպես մարմնական միոպատիայի անսովոր ձև, որն ասոցացվում է Պեյջի հիվանդության և ճակատքունքային դեմենցիայի հետ[11][15][20]։
Պրենատալ թեստավորում
[խմբագրել | խմբագրել կոդը]Գենետիկական թեստավորումն այդ թվում նաև պրենատալ թեստավորումն իրականացվում է երկու ձևերն հաստատելու համար։ Մոլեկուլյար թեստավորումը համարվում է ախտորոշման ոսկե ստանդարտ։
Հղիության ընթացքում թեստավորումն, որպեսզի պարզվի արդյոք դեռ չծնված երեխան ախտահարված է, հնարավոր է միայն այն դեպքում, երբ ընտանիքում հաստատված է DMPK գենի մուտացիան։ Այն կարող է կատարվել գեստացիայի 10-12 շաբաթում։ Պրոցեդուրան կոչվում է խորիոնալ թավիկների նմուշառում, որի ընթացքում հեռացվում է պլացենտայի փոքրիկ կտոր և հետազոտվում է նրա բջիջների ԴՆԹ-ն։ Թեստավորումը կարելի է իրականացնել նաև գեստացիայի 14րդ շաբաթից ամնիոցենտեզի միջոցով։ Հեռացվում է փոքր քանակի հարպտղային ջրեր և կատարվում է բջջային հետազոտում։ Այս պրոցեդուրաններից յուրաքանչյուրն ունի վիժման վտանգ, և նրանք, ովքեր հետաքրքրված են ավելին իմանալով, պետք է դիմեն իրենց բժշկին կամ գենետիկական խորհրդատուին։ Կա նաև մեկ այլ պրոցեդուրա, ոը կոչվում է պրեիմպլանտացիոն ախտորոշում, այն թույլ է տալիս զույգին ունենալ չախտահարված երեխա։ Այն փորձնական է և լայն տարածում չունի։ Նրանք, ովքեր ուզում են ավելի շատ տեղեկանալ այդ մասին, պետք է դիմեն իրենց բժշկին կամ գենեիկական խորհրդատուին։
Կանխատեսիչ թեստավորում
[խմբագրել | խմբագրել կոդը]Հնարավոր է կատարել ՄԴ1 զարգացման ռիսկի խմբում գտնվոզ անահատների թեստավորում նախքան նրանք կունենան տեսանելի ախտանիշներ:Այս մեթոդը կոչվում է կանխատեսիչ թեսստավորում:Կանխատեսիչ թեստավորումը չի կարող որոշել հիվանդության սկիզբը, ծանրության աստիճանն ու ընթացքը։
Կառավարում
[խմբագրել | խմբագրել կոդը]Ներկայումս չկա միոտոնիկ դիստրոֆիայի սպեցիֆիկ բուժում։ Այդ պատճառով ուշադրություն է դարձվում հիվանդության բարդություններին, հակապես սիրտ-անոթային, որոնք 70 տոկոս դեպքերում մահվան պատճառ են հանդիսանում[11]։ Կարդիոխթանիչի տեղադրումն կարող է անհրաժեշտ լինել սիրտ-անոթային հաղորդականության խանգարմամբ անձանց համար։ Կյանքի որակի բարելավումը, որը կարելի է ստուգել հատուկ հարցաշարերի միջոցով[21] բժշկական օգնության հիմնական խնդիր է։ Քնի կենտրոնական ապնոեն կամ օբստրուկտիվ ապնոեն առաջացնոում է ցերեկային քնկոտություն։ Այսիպի անձինք պետք է անցնեն քնի հետազոտություն։ Կարող է նաև առաջարկվել ոչ ինվազիվ օդափոխություն։ Հակառակ դեպքում կան վկայություններ մոդաֆինիլի մասին որպես կենտրոնական նյարդային համակարգը խթանող միջոց, սակայն Կոկրանովսկու հետազոտությունները վկայում են, որ այդ փաստերը այնքան էլ համոզիչ չեն[փա՞ստ]։
Որոշ հետազոտություններ պարզել են, որ իմիպրամինը, քլոմիապրամինը և տաուրինը կարող են օգտակար լինել միոպատիայի բուժման նպատակով[11]։ Այնուամենայնիվ, թերի ապացույցների նաև պոտենցիալ կողմնակի ազդեցությունների հետևանքով (սրտային առիթմիա) այս մեթոդը հազվադեպ է կիրառվում։ 2015 թվականի դեկտեմբերին անցկացված հետազոտությունը ցույց է տվել, որ ՖԴԱ-ի կողմից հաստատված հակբիոտիկ Էրիթրոմիցինը նվազեցնում է միոտոնիան մկների մոտ[22]։ Պլանավորվում են փորձարկումներ մարդկանց վրա Էրիթրոմիցինով։ Այն հաջողությամբ կիրառվում է ստամոքսի խնդիրներով մարդանց մոտ[23]։
Ցույց է տրվել, որ մկան յուրահատուկ քլորիդային անցուղի 1-ի սպլայսինգի փոփոխությունը բերում է ՄԴ1 ֆենոտիպի զարգացման, որը դառնալի է մկների մոդելի վրա Մորֆոլինոյի միջոցով, որը մոդիֆիկացիայի է ենթարկում անցուղի 1-ի մՌՆԹ-ի սպլասինգիը[24]։
Ֆիզիկալ ակտիվություն
[խմբագրել | խմբագրել կոդը]Համակցված ամրապնդող և միջին ծանրության աերոբ մարզումները անվտանգ են համարվում նյարդամկանային հիվանդությամբ անձանց համար[25]։ Համակցումը բարելավում է մկանային ուժը[26]։ Մասնավորապես էրգոմետրով ստատիկ հեծանվային աերոբ վարժությունները էֆֆեկտիվ են ՄԴ1 ունեցող անհատների ֆիզիկական վիճակը բարելավելու հարցում[27]։ Ուժային մարզումն ու աերոբիկական վարժությունները նպաստում են մկանային և կարդիոռեսպիրտոր ֆունկցիաներին՝ կանխելով հետագա ատրոֆիան[28]։
Սիրտանոթային խնդիրները, մկանային զգայունությունը վարժությունների և ջերմաստիճանի նկատմամբ ստիպում են կատարել մարակրկիտ մոնիթորինգ նաև սովորեցնել տվյալ մարդկանց վարժությունների ընթացքում Բորգի սանդղակով, սրտային ռիթմի մոնիտորներով և այլ ֆիզիկալ ծանրաբեռնվածության չափորոշիչներով կատարել ինքնավերահսկում[29]։
Շարժունակության օժանդակ միջոցներ և հարմարվողական սարքավորումներ
[խմբագրել | խմբագրել կոդը]Վերին և ստորին վերջույթների թուլությունը, տեսողական խանգարումներն և միոտոնիան հանգեցնում են շարժողական օժանդակ միջոցների և ֆունկցիոնալ ադապտիվ սարքավորումների կիրառմանը[11]։
Համաճարակաբանություն
[խմբագրել | խմբագրել կոդը]ՄԴ1 երեխաների մոտ ախտորոշված առավել հաճախ հանդիպող միոտոնիկ մկանային դիստրոֆիան է։ Ճապոնիայում հանդիպում է 1:100.000, իսկ Եվրոպայում 15:100.000 հաճախականությամբ[11]։ Այնպիսի մարզերում, ինչպիսին է Կվեբեկը, տարածվածությունը կարող է հասնել 1:500։ Բնակչության մեծ մասում DM1- ը առավել տարածված է, քան DM2- ը:Այնուամենայնիվ վերջին հետազոտությունները ցույց են տվաել, որ տիպ 2-ը Գերմանիայում և Ֆինլանդիայում կարող է նույնքան տարծված լինել ինչպես տիպ1-ը[3]։
Բնածին միոտոնիկ դիստրոֆիայի տարածվածությունը կազմում է 1:20.000: ՄԴ հանդիպում է 7.000-8.000 անհատից մեկի մոտ և նկարագրված է ամբողջ աշխարհում[փա՞ստ]։ Այն ախտահարում է կանանց և տղամարդկանց գրեթե հավասարապես:Միացյալ նահանգներում տառապում է շուրջ 30.000 մարդ։
Պատմություն
[խմբագրել | խմբագրել կոդը]Միոտոնիկ դիստրոֆիան առաջին անգամ նկարագրել է գերմանացի բժիշկ Հանս Գուստավ Վիլհելմ Շտայնտերտը, ով հրապարակել է 6 դեպքեր նկարագրված 1909 թվականին[30]։ Ավելի վաղ նկարագրվել է այլ առանձին դեպք ներառյալ Ֆրեդերիկ Էուստաս Բատտենի և Հանս Կուրսշմանի հաղորդումները։ Այդ պատճառով հաճախ տիպ 1-ը կոչվում է նաև Կուրսշման-Բատտեն-Շտայնտերտի սինդրոմ[31]։ Տիպ 1-ի հիմքում ընկած պատճառը հայտնաբերվել է 1992 թվականին[4]։
Ծանոթագրություններ
[խմբագրել | խմբագրել կոդը]- ↑ 1,00 1,01 1,02 1,03 1,04 1,05 1,06 1,07 1,08 1,09 1,10 1,11 1,12 Bednařík J., Ambler Z., Růžička E. Klinická neurologie: část speciální — ISBN 978-80-7387-389-9
- ↑ 2,0 2,1 Campbell C., Levin S., Siu V. M., Venance S., Jacob P. Congenital myotonic dystrophy: Canadian population-based surveillance study. // J. Pediatr. — Elsevier BV, 2013. — Vol. 163, Iss. 1. — P. 120—5.e1—3. — ISSN 0022-3476; 1097-6833; 1085-8695 — doi:10.1016/J.JPEDS.2012.12.070 — PMID:23415617
- ↑ 3,00 3,01 3,02 3,03 3,04 3,05 3,06 3,07 3,08 3,09 3,10 3,11 3,12 3,13 «myotonic dystrophy». GHR. 2016 թ․ հոկտեմբերի 11. Արխիվացված օրիգինալից 2016 թ․ հոկտեմբերի 18-ին. Վերցված է 2016 թ․ հոկտեմբերի 16-ին.
- ↑ 4,0 4,1 4,2 4,3 4,4 4,5 Meola, G; Cardani, R (April 2015). «Myotonic dystrophies: An update on clinical aspects, genetic, pathology, and molecular pathomechanisms». Biochimica et Biophysica Acta. 1852 (4): 594–606. doi:10.1016/j.bbadis.2014.05.019. PMID 24882752.
- ↑ Klein, AF; Dastidar, S; Furling, D; Chuah, MK (2015). «Therapeutic Approaches for Dominant Muscle Diseases: Highlight on Myotonic Dystrophy». Current Gene Therapy. 15 (4): 329–37. doi:10.2174/1566523215666150630120537. PMID 26122101.
- ↑ Yanoff, Myron; Jay S. Duker (2008). Ophthalmology (3rd ed.). Edinburgh: Mosby. էջ 411. ISBN 978-0323057516.
- ↑ Mahadevan M, Tsilfidis C, Sabourin L, Shutler G, Amemiya C, Jansen G, Neville C, Narang M, Barceló J, O'Hoy K (March 1992). «Myotonic dystrophy mutation: an unstable CTG repeat in the 3' untranslated region of the gene». Science. 255 (5049): 1253–5. Bibcode:1992Sci...255.1253M. doi:10.1126/science.1546325. PMID 1546325.
- ↑ van der Ven PF, Jansen G, van Kuppevelt TH, Perryman MB, Lupa M, Dunne PW, ter Laak HJ, Jap PH, Veerkamp JH, Epstein HF (November 1993). «Myotonic dystrophy kinase is a component of neuromuscular junctions». Hum. Mol. Genet. 2 (11): 1889–94. doi:10.1093/hmg/2.11.1889. PMID 8281152.
- ↑ Harley HG, Walsh KV, Rundle S, Brook JD, Sarfarazi M, Koch MC, Floyd JL, Harper PS, Shaw DJ (May 1991). «Localisation of the myotonic dystrophy locus to 19q13.2-19q13.3 and its relationship to twelve polymorphic loci on 19q». Hum. Genet. 87 (1): 73–80. doi:10.1007/BF01213096. PMID 2037285.
- ↑ Bird, Thomas D. (1993 թ․ հունվարի 1). «Myotonic Dystrophy Type 1». GeneReviews(®). Արխիվացված օրիգինալից 2017 թ․ հունվարի 18-ին. Վերցված է 2016 թ․ մայիսի 9-ին.update 2015
- ↑ 11,0 11,1 11,2 11,3 11,4 11,5 11,6 11,7 Turner C, Hilton-Jones D (April 2010). «The myotonic dystrophies: diagnosis and management». J. Neurol. Neurosurg. Psychiatry. 81 (4): 358–67. doi:10.1136/jnnp.2008.158261. PMID 20176601.
- ↑ 12,0 12,1 Usdin K, House NC, Freudenreich CH (2015). «Repeat instability during DNA repair: Insights from model systems». Crit. Rev. Biochem. Mol. Biol. 50 (2): 142–67. doi:10.3109/10409238.2014.999192. PMC 4454471. PMID 25608779.
- ↑ Ho TH, Savkur RS, Poulos MG, Mancini MA, Swanson MS, Cooper TA (July 2005). «Colocalization of muscleblind with RNA foci is separable from mis-regulation of alternative splicing in myotonic dystrophy». J. Cell Sci. 118 (Pt 13): 2923–33. doi:10.1242/jcs.02404. PMID 15961406.
- ↑ 14,0 14,1 14,2 Day JW, Ricker K, Jacobsen JF, Rasmussen LJ, Dick KA, Kress W, Schneider C, Koch MC, Beilman GJ, Harrison AR, Dalton JC, Ranum LP (February 2003). «Myotonic dystrophy type 2: molecular, diagnostic and clinical spectrum». Neurology. 60 (4): 657–64. doi:10.1001/archneur.60.5.657. PMID 12601109.
- ↑ 15,0 15,1 Dalton, Joline C.; Ranum, Laura PW; Day, John W. (1993 թ․ հունվարի 1). Pagon, Roberta A.; Adam, Margaret P.; Ardinger, Holly H.; Wallace, Stephanie E.; Amemiya, Anne; Bean, Lora JH; Bird, Thomas D.; Fong, Chin-To; Mefford, Heather C. (eds.). Myotonic Dystrophy Type 2. Seattle (WA): University of Washington, Seattle. PMID 20301639. Արխիվացված օրիգինալից 2017 թ․ հունվարի 28-ին.updated 2013
- ↑ Liquori CL, Ricker K, Moseley ML, Jacobsen JF, Kress W, Naylor SL, Day JW, Ranum LP (August 2001). «Myotonic dystrophy type 2 caused by a CCTG expansion in intron 1 of ZNF9». Science. 293 (5531): 864–7. doi:10.1126/science.1062125. PMID 11486088.
- ↑ «Juvenile-Onset MMD1». Muscular Dystrophy Association. MDA. Արխիվացված է օրիգինալից 2015 թ․ մարտի 8-ին. Վերցված է 2015 թ․ մարտի 17-ին.
- ↑ «Myotonic dystrophy: Etiology, clinical features, and diagnosis». Արխիվացված օրիգինալից 2014 թ․ փետրվարի 22-ին. Վերցված է 2014 թ․ փետրվարի 15-ին.
- ↑ Le Ber I, Martinez M, Campion D, Laquerrière A, Bétard C, Bassez G, Girard C, Saugier-Veber P, Raux G, Sergeant N, Magnier P, Maisonobe T, Eymard B, Duyckaerts C, Delacourte A, Frebourg T, Hannequin D (September 2004). «A non-DM1, non-DM2 multisystem myotonic disorder with frontotemporal dementia: phenotype and suggestive mapping of the DM3 locus to chromosome 15q21-24». Brain. 127 (Pt 9): 1979–92. doi:10.1093/brain/awh216. PMID 15215218.
- ↑ Udd B, Meola G, Krahe R, Thornton C, Ranum LP, Bassez G, Kress W, Schoser B, Moxley R (June 2006). «140th ENMC International Workshop: Myotonic Dystrophy DM2/PROMM and other myotonic dystrophies with guidelines on management». Neuromuscul. Disord. 16 (6): 403–13. doi:10.1016/j.nmd.2006.03.010. PMID 16684600.
- ↑ «Construction of a Quality of Life Questionnaire for slowly progressive neuromuscular disease»։ Qual Life Res 24 (11): 2615–23։ November 2015։ PMID 26141500։ doi:10.1007/s11136-015-1013-8
- ↑ Nakamori M, Taylor K, Mochizuki H, Sobczak K, Takahashi MP (January 2016). «Oral administration of erythromycin decreases RNA toxicity in myotonic dystrophy». Ann Clin Transl Neurol. 3 (1): 42–54. doi:10.1002/acn3.271. PMC 4704483. PMID 26783549.
- ↑ Rönnblom A, Andersson S, Hellström PM, Danielsson A (August 2002). «Gastric emptying in myotonic dystrophy». Eur. J. Clin. Invest. 32 (8): 570–4. doi:10.1046/j.1365-2362.2002.01028.x. PMID 12190956.
- ↑ Wheeler TM, Lueck JD, Swanson MS, Dirksen RT, Thornton CA (December 2007). «Correction of ClC-1 splicing eliminates chloride channelopathy and myotonia in mouse models of myotonic dystrophy». J. Clin. Invest. 117 (12): 3952–7. doi:10.1172/JCI33355. PMC 2075481. PMID 18008009.
- ↑ Voet NB, van der Kooi EL, Riphagen II, Lindeman E, van Engelen BG, Geurts AC (July 2013). «Strength training and aerobic exercise training for muscle disease». Cochrane Database Syst Rev (7): CD003907. doi:10.1002/14651858.CD003907.pub4. hdl:2066/123481. PMID 23835682.
- ↑ Cup EH, Pieterse AJ, Ten Broek-Pastoor JM, Munneke M, van Engelen BG, Hendricks HT, van der Wilt GJ, Oostendorp RA (November 2007). «Exercise therapy and other types of physical therapy for patients with neuromuscular diseases: a systematic review». Arch Phys Med Rehabil. 88 (11): 1452–64. doi:10.1016/j.apmr.2007.07.024. PMID 17964887.
- ↑ Orngreen MC, Olsen DB, Vissing J (May 2005). «Aerobic training in patients with myotonic dystrophy type 1». Ann. Neurol. 57 (5): 754–7. doi:10.1002/ana.20460. PMID 15852373.
- ↑ Voet NB, van der Kooi EL, Riphagen II, Lindeman E, van Engelen BG, Geurts AC (January 2010). «Strength training and aerobic exercise training for muscle disease». Cochrane Database Syst Rev (1): CD003907. doi:10.1002/14651858.CD003907.pub3. hdl:2066/123481. PMID 20091552.
- ↑ Pandya, S; Eichinger, K. «Role of physical therapy in the assessment and management of individuals with myotonic dystrophy». Myotonic Dystrophy Foundation. Արխիվացված է օրիգինալից 2015 թ․ սեպտեմբերի 26-ին. Վերցված է 2012 թ․ մայիսի 5-ին.
- ↑ Mishra SK, Singh S, Lee B, Khosa S, Moheb N, Tandon VA (2018). «"Dystrophia Myotonica" and the Legacy of Hans Gustav Wilhelm Steinert». Ann Indian Acad Neurol. 21 (2): 116–118. doi:10.4103/aian.AIAN_182_17. PMC 6073962. PMID 30122835.
{{cite journal}}: CS1 սպաս․ չպիտակված ազատ DOI (link) - ↑ Olbrych-Karpińska B, Tutaj A (September 1981). «[Case of Curschmann-Batten-Steinert syndrome]». Wiad. Lek. (Polish). 34 (17): 1467–9. ISSN 0043-5147. PMID 7331343.
{{cite journal}}: CS1 սպաս․ չճանաչված լեզու (link)
| Այս հոդվածը կատեգորիայի կարիք ունի։ Դուք կարող եք օգնել նախագծին՝ կատեգորիա գտնել կամ ստեղծել ու ավելացնել հոդվածին։ |