Acidi carbossilici

R gruppo alchilico
carbonio
ossigeno
idrogeno
Gli acidi carbossilici sono una classe di molecole organiche che contengono uno o più gruppi carbossilici (−COOH o −CO2H). A seconda della struttura legata al gruppo carbossilico, possono essere molecole alifatiche, eterocicliche, aromatiche, sia sature sia insature.[1][2]
Nomenclatura
[modifica | modifica wikitesto]Gli acidi carbossilici sono generalmente noti con il loro nome comune, poiché la loro scoperta è avvenuta prima dell'introduzione delle regole IUPAC, risalenti al 1959 e riviste fino al 1990. I loro nomi comuni sono spesso legati alle fonti organiche o inorganiche da cui sono stati isolati le prime volte.
La nomenclatura IUPAC degli acidi carbossilici alifatici, si basa sul conteggio degli atomi di carbonio della catena principale. Il nome assegnato è sempre composto da due parole: la prima è acido, mentre la seconda ha un prefisso che fa riferimento all'alcano corrispondente in base al numero di atomi di carbonio, e il suffisso -oico.
Se l'acido carbossilico ha nella sua struttura due gruppi −COOH, viene definito dicarbossilico e il suffisso della seconda parola del suo nome diventa -dioico. Se invece ne possiede tre, viene definito acido tricarbossilico e il suffisso si trasforma in -trioico, e così via con sostituenti sempre più numerosi.
| Atomi di carbonio | Nome comune | Nome IUPAC | Formula molecolare | Dove si trova |
|---|---|---|---|---|
| 1 | Acido formico | Acido metanoico | HCOOH | Pungiglioni degli insetti |
| 2 | Acido acetico | Acido etanoico | CH3COOH | Aceto |
| 3 | Acido propionico | Acido propanoico | CH3CH2COOH | Latte |
| 4 | Acido butirrico | Acido butanoico | CH3(CH2)2COOH | Burro rancido |
| 5 | Acido valerico | Acido pentanoico | CH3(CH2)3COOH | Valeriana officinalis |
| 6 | Acido caproico | Acido esanoico | CH3(CH2)4COOH | Latte di capra |
| 7 | Acido enantico | Acido eptanoico | CH3(CH2)5COOH | Piante del genere Oenanthe |
| 8 | Acido caprilico | Acido ottanoico | CH3(CH2)6COOH | Latte di capra |
| 9 | Acido pelargonico | Acido nonanoico | CH3(CH2)7COOH | Piante del genere Pelargonium |
| 10 | Acido caprico | Acido decanoico | CH3(CH2)8COOH | Latte di capra |
| 2 | Acido ossalico | Acido etandioico | HOOC−COOH | Piante del genere Oxalis |
| 3 | Acido malonico | Acido 1,3-propandioico | HOOC−CH2−COOH | Mela e altri frutti, dal greco malon |
| 4 | Acido succinico | Acido 1,4-butandioico | HOOC−(CH2)2−COOH | Ambra, dal latino succinum |
| Classi di acidi carbossilici | Breve descrizione | Esempi |
|---|---|---|
| Acidi monocarbossilici | Acidi che contengono 1 gruppo carbossilico, catena carboniosa alifatica, eterociclica, aromatica, satura o insatura. | acido acetico, acido formico, acido acrilico, acido benzoico, acido salicilico, acido cinnamico, acido caffeico |
| Acidi dicarbossilici | Acidi che contengono 2 gruppi carbossilici, catena carboniosa alifatica, eterociclica, aromatica, satura o insatura. | acido adipico, acido aldarico, acido ossalico, acido ftalico, acido azelaico, acido sebacico |
| Acidi tricarbossilici | Acidi che contengono 3 gruppi carbossilici, catena carboniosa alifatica, eterociclica, aromatica, satura o insatura. | acido citrico, acido isocitrico |
| Acidi grassi | Acidi monocarbossilici saturi o insaturi con catena lineare di almeno 4 atomi di carbonio, componenti costitutivi di lipidi, fosfolipidi, ecc. | acido butirrico, acido oleico, acido palmitico, acido stearico |
| Amminoacidi | Acidi mono/dicarbossilici con porzioni amminiche, componenti costitutivi di proteine e altre molecole. | acido glutammico, acido aspartico, GABA |
| Chetoacidi | Acidi carbossilici contenenti uno o più gruppi carbonilici. | acido acetoacetico, acido piruvico, acido levulinico |
| Idrossiacidi | Acidi carbossilici contenenti uno o più gruppi ossidrile. | acido glicolico, acido lattico, acido salicilico, acido gentisico |
Caratteristiche
[modifica | modifica wikitesto]Solubilità e punto di ebollizione
[modifica | modifica wikitesto]
Gli acidi carbossilici sono polari e possono formare legami idrogeno sia ricevendo, con il gruppo carbonilico (−C=O), sia donando, con il gruppo ossidrile (−OH). Formano facilmente legami idrogeno sia con sé stessi sia con altre molecole.
I più leggeri tra gli acidi carbossilici, fino a 3 atomi di carbonio, sono composti solubili in acqua con odori pungenti; i successivi sono liquidi oleosi con un alto punto di ebollizione. Al crescere del peso molecolare, gli acidi carbossilici diventano solidi cerosi bassofondenti.
In virtù dei legami ad idrogeno hanno normalmente un elevato punto di ebollizione, più alto del rispettivo alcole.
Acidità
[modifica | modifica wikitesto]Sono composti che manifestano un comportamento acido debole, per via della stabilizzazione per risonanza dell'anione che viene a formarsi (uno ione carbossilato) per dissociazione dello ione H+ del gruppo idrossile. Sono più acidi dei fenoli e molto più acidi degli alcoli. L'acidità di un acido carbossilico è tanto più pronunciata quanto più corta è la catena alchilica. Il Ka, cioè l'opposto del logaritmo in base 10 della costante di dissociazione acida degli acidi monocarbossilici è generalmente superiore a 4, ma la presenza di sostituenti elettronegativi (Cl, F) o di un gruppo idrossile in posizione 2, aumenta l'acidità.
| Acidi carbossilici[3] | pKa |
|---|---|
| Acido formico (HCOOH) | 3,75 |
| Acido acetico (CH3COOH) | 4,76 |
| Acido butirrico (CH3CH2CH2COOH) | 4,82 |
| acido 2-idrossietanoico (HOCH2COOH) | 3,83 |
| Acido 2-idrossipropanoico (CH3CH(OH)COOH) | 3,86 |
| Acido cloroacetico (CH2ClCOOH) | 2,86 |
| Acido dicloroacetico (CHCl2COOH) | 1,29 |
| Acido tricloroacetico (CCl3COOH) | 0,65 |
| Acido trifluoroacetico (CF3COOH) | 0,23 |
| Acido ossalico (HO2CCOOH) | 1,27 |
| Acido benzoico (C6H5COOH) | 4.2 |
| Acido 2-idrossibenzoico (C6H4OHCOOH) | 2,97 |
La presenza nella molecola di gruppi capaci di stabilizzare l'anione disperdendone o attenuandone la carica negativa (sia per risonanza sia per effetto induttivo) tende ad aumentare la forza dell'acido; gruppi che invece de-stabilizzano l'anione intensificandone la carica negativa hanno l'effetto opposto di diminuire l'acidità della molecola.
Produzione degli acidi carbossilici
[modifica | modifica wikitesto]Gli acidi carbossilici si preparano principalmente per ossidazione di alcoli primari e aldeidi (con reattivi ossidanti più o meno energici a seconda del substrato), oppure per idrolisi di esteri, ammidi, anidridi, alogenuri acilici e nitrili.
Produzione per ossidazione di alcol e aldeidi
[modifica | modifica wikitesto]
Come ossidante è preferibile utilizzare l'acido nitrico HNO3 in quanto è meno costoso di CrO3 e KMnO4.
Produzione per addizione di anidride carbonica a un reattivo di Grignard
[modifica | modifica wikitesto]Un altro metodo di preparazione è quello che fa uso dei reattivi di Grignard e anidride carbonica:
La carbonatazione di un reattivo di Grignard rappresenta una via molto conveniente per ottenere acidi carbossilici a partire da un alogenuro alchilico (R-X) o arilico (Ar-X); inoltre l'anidride carbonica è facilmente reperibile (il che è un aspetto non trascurabile dal punto di vista economico).
Idrolisi dei nitrili
[modifica | modifica wikitesto] HA OH-
R-CH2-X + NaCN → R-CH2-COOH + NH4+ / R-CH2 -X + NaCN → R-CH2-COOH + NH3
H2O H2O
Questa tecnica costituisce un metodo per convertire un alogenuro alchilico in acido carbossilico con un atomo di carbonio in più rispetto all'alogenuro di partenza ("x" viene sostituito con COOH).
Essendo una SN2 se l'alogenuro è chirale avviene l'inversione al carbonio che subisce la SN2.
Proprietà chimico-fisiche
[modifica | modifica wikitesto]Gli acidi carbossilici sono molecole polari e presentano una solubilità simile (o superiore) a quella dei relativi alcoli: i primi termini della serie sono solubili in acqua; sono abbastanza solubili anche in alcoli, eteri e benzene.
Sono molecole caratterizzate dalla formazione di legami a idrogeno, e per questo motivo presentano punti di ebollizione elevati.
Reazioni tipiche
[modifica | modifica wikitesto]Gli acidi carbossilici subiscono principalmente reazioni di sostituzione del gruppo idrossile con altri gruppi, formando alogenuri, esteri, anidridi e ammidi. Alcuni loro sali possono essere de-carbossilati per riscaldamento, con conseguente perdita di biossido di carbonio.
Dalla disidratazione di un acido carbossilico si ottiene la corrispondente anidride organica, simile agli ossidi acidi inorganici solo nel comportamento, dato che come questi ultimi liberano l'acido in presenza di acqua. Infatti, secondo la IUPAC il termine anidride deve essere riservato agli acidi organici.
La reazione tipica che porta alla formazione di un'anidride è:
Gli acidi carbossilici, danno forma a reazioni di addizione di H+ e CN- cioè un'azione radicalica nucleofila perché il carbonio è positivizzato. I nucleofili più importanti sono i gruppi ROH-.
Successivamente si ha una reazione di sostituzione dove avviene una delocalizzazione degli elettroni e la formazione di una molecola d'acqua, dando forma a un estere se il reagente è un alcol o un'ammide se il reagente è un'ammina.
Decarbossilazione degli acidi e alogenazione
[modifica | modifica wikitesto]In condizioni particolari gli acidi carbossilici possono perdere una molecola di CO2 (decarbossilazione).
La reazione di Hunsdiecker, per esempio, si basa su un processo di decarbossilazione seguito da un'alogenazione:
Un'altra reazione, particolarmente interessante per le implicazioni biochimiche, è la decarbossilazione a carico dei β-chetoacidi, se riscaldati sopra i 100 °C:
Riduzione
[modifica | modifica wikitesto]La reazione di riduzione degli acidi carbossilici con più resa è data da BH3 in tetraidrofurano con ambiente acido.
Derivati degli acidi carbossilici
[modifica | modifica wikitesto]Cloruri acilici
[modifica | modifica wikitesto]La trasformazione diretta del carbossile in cloruro acilico è una reazione che si realizza con i seguenti agenti cloruranti: SOCl2, PCl3, PCl5.
Attraverso analoghi alogenuri è possibile ottenere anche i bromuri e ioduri di acile.
Anidridi
[modifica | modifica wikitesto]La preparazione diretta delle anidridi dagli acidi non è agevole anche se praticabile in presenza di un disidratante a elevata temperatura.
Più facile è la realizzazione con un alogeno acilico e un sale dell'acido carbossilico:
Esteri
[modifica | modifica wikitesto]Molteplici sono i metodi di preparazione degli esteri. I tre metodi più comuni svolgono il meccanismo tetraedrico.
- Gli esteri si ottengono dalla reazione fra i cloruri o bromuri acilici e gli alcoli o i fenoli (in presenza di una base).
- (catalizzatore: piridina)
- Altro metodo di preparazione comporta la reazione di un'anidride un alcol o un fenolo.
- Più interessante è la preparazione degli esteri da acidi carbossilici e alcol catalizzati da una piccola dose di acido (H2SO4, H3PO4, HCl). La reazione è conosciuta come esterificazione di Fischer (Nobel per la chimica nel 1902) e risale al 1895.
Ammidi
[modifica | modifica wikitesto]Le ammidi si preparano dagli alogenuri acilici e dalle anidridi, principalmente, secondo le reazioni di sostituzione nucleofila acilica. Ad esempio:
- Dagli alogenuri acilici:
- Dalle anidridi:
Alcuni acidi carbossilici
[modifica | modifica wikitesto]- Acido acetico
- Acido 2,4-diclorofenossiacetico
- Acido iodoacetico
- Acido arachico
- Acido ftalico
- Acido maleico
- EDTA
Note
[modifica | modifica wikitesto]- ^ (EN) IUPAC Gold Book, "carboxylic acids"
- ^ carbossilici, acidi nell'Enciclopedia Treccani, su www.treccani.it. URL consultato il 7 marzo 2023.
- ^ William M. Haynes, CRC Handbook of Chemistry and Physics, n. 92, CRC Press, 2011, pp. 5–94 e 5–98, ISBN 1439855110.
Bibliografia
[modifica | modifica wikitesto]- T. W. Graham Solomons, Chimica organica, 2ª ed., Bologna, Zanichelli, 2001, pp. 57-58, ISBN 88-08-09414-6.
Altri progetti
[modifica | modifica wikitesto] Wikiquote contiene citazioni di o su acido carbossilico
Wikiquote contiene citazioni di o su acido carbossilico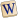 Wikizionario contiene il lemma di dizionario «acido carbossilico»
Wikizionario contiene il lemma di dizionario «acido carbossilico» Wikimedia Commons contiene immagini o altri file su acido carbossilico
Wikimedia Commons contiene immagini o altri file su acido carbossilico
Collegamenti esterni
[modifica | modifica wikitesto]- Esperienze in laboratorio - Gli acidi carbossilici, su itchiavari.org.
- Esercizi sulla Nomenclatura degli Acidi Carbossilici, su mnemochimica.it.
| Controllo di autorità | LCCN (EN) sh85020144 · GND (DE) 4009464-9 · J9U (EN, HE) 987007283483205171 · NDL (EN, JA) 00565061 |
|---|