삼플루오린화 염소
보이기
| |||
| 이름 | |||
|---|---|---|---|
| 체계명
Trifluoro-λ3-chlorane[1] (substitutive) | |||
| 별칭
Chlorotrifluoride
| |||
| 식별자 | |||
3D 모델 (JSmol)
|
|||
| ChEBI | |||
| ChemSpider | |||
| ECHA InfoCard | 100.029.301 | ||
| EC 번호 |
| ||
| 1439 | |||
| MeSH | chlorine+trifluoride | ||
PubChem CID
|
|||
| RTECS 번호 |
| ||
| UNII | |||
| UN 번호 | 1749 | ||
CompTox Dashboard (EPA)
|
|||
| |||
| |||
| 성질 | |||
| ClF3 | |||
| 몰 질량 | 92.45 g·mol−1 | ||
| 겉보기 | Colorless gas or greenish-yellow liquid | ||
| 냄새 | Sweet, pungent, irritating, suffocating[2][3] | ||
| 밀도 | 3.779 g/L[4] | ||
| 녹는점 | −76.34 °C (−105.41 °F; 196.81 K)[4] | ||
| 끓는점 | 11.75 °C (53.15 °F; 284.90 K)[4] (decomposes at 180 °C (356 °F; 453 K)) | ||
| Reacts with water[1] | |||
| 용해도 | Soluble in carbon tetrachloride but explosive in high concentrations. Reacts with hydrogen-containing compounds e.g. hydrogen, methane, benzene, ether, ammonia.[1] | ||
| 증기 압력 | 175 kPa | ||
자화율 (χ)
|
−26.5×10−6 cm3/mol[5] | ||
| 점도 | 91.82 μPa s | ||
| 구조 | |||
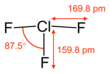
| T-shaped molecular geometry | |||
| 열화학[6] | |||
열용량 (C)
|
63.9 J K−1 mol−1 | ||
표준 몰 엔트로피 (S
|
281.6 J K−1 mol−1 | ||
표준 생성 엔탈피 (ΔfH⦵298)
|
−163.2 kJ mol−1 | ||
기브스 자유 에너지 (ΔfG˚)
|
−123.0 kJ mol−1 | ||
| 위험 | |||
| 주요 위험 | Very toxic, very corrosive, powerful oxidizer, violent hydrolysis[3] | ||
| 물질 안전 보건 자료 | [1] | ||
| GHS 그림문자 |    
| ||
| 신호어 | 위험 | ||
| NFPA 704 (파이어 다이아몬드) | |||
| 인화점 | noncombustible [3] | ||
| 반수 치사량 또는 반수 치사농도 (LD, LC): | |||
LC50 (median concentration)
|
95 ppm (rat, 4 hr) 178 ppm (mouse, 1 hr) 230 ppm (monkey, 1 hr) 299 ppm (rat, 1 hr) [7] | ||
| NIOSH (미국 건강 노출 한계): | |||
PEL (허용)
|
C 0.1 ppm (0.4 mg/m3)[3] | ||
REL (권장)
|
C 0.1 ppm (0.4 mg/m3)[3] | ||
IDLH (직접적 위험)
|
20 ppm[3] | ||
| 관련 화합물 | |||
관련 화합물
|
Chlorine pentafluoride Chlorine monofluoride | ||
달리 명시된 경우를 제외하면, 표준상태(25 °C [77 °F], 100 kPa)에서 물질의 정보가 제공됨.
| |||
삼플루오린화 염소, 삼플루오르화 염소, 삼불화 염소(Chlorine trifluoride)는 화학식 ClF3을 갖는 할로겐간 화합물이다. 무색이고 독성이 있고 부식성이 있으며 반응성이 매우 높은 기체이며 연한 녹색을 띤 노란색 액체로 응축되며, 가장 흔히 판매되는 형태이다(상온에서 가압). 극도의 산화 특성과 많은 물질을 발화시키는 것으로 유명함에도 불구하고 삼불화염소 자체는 가연성이 아니다. 이 화합물은 부식성 특성으로 인해 반도체 산업, 원자로 연료 처리, 역사적으로 로켓 연료의 구성 요소로서 플라즈마 없는 세척 및 에칭 작업과 다양한 기타 산업 작업에 주로 관심을 갖고 있다.
각주
[편집]- ↑ 가 나 다 “Chlorine trifluoride”. 《PubChem Compound》. National Center for Biotechnology Information. 2023년 7월 4일. 2023년 7월 8일에 확인함.
- ↑ ClF3/Hydrazine 보관됨 2007-02-02 - 웨이백 머신 at the Encyclopedia Astronautica.
- ↑ 가 나 다 라 마 바 NIOSH Pocket Guide to Chemical Hazards. “#0117”. 미국 국립 직업안전위생연구소 (NIOSH).
- ↑ 가 나 다 Haynes, William M., 편집. (2011). 《CRC Handbook of Chemistry and Physics》 92판. CRC Press. 4.58쪽. ISBN 978-1-4398-5511-9.
- ↑ Haynes, William M., 편집. (2011). 《CRC Handbook of Chemistry and Physics》 92판. CRC Press. 4.132쪽. ISBN 978-1-4398-5511-9.
- ↑ Haynes, William M., 편집. (2011). 《CRC Handbook of Chemistry and Physics》 92판. CRC Press. 5.8쪽. ISBN 978-1-4398-5511-9.
- ↑ “Chlorine trifluoride”. 《Immediately Dangerous to Life and Health Concentrations (IDLH)》. National Institute for Occupational Safety and Health (NIOSH).