Metilasyon
Kimyada metilasyon veya metillenme, bir kimyasal bileşiğe bir metil grubunun bağlanması veya sübstitüsyonudur. Bu terim kimyada, biyokimyada, toprak bilimlerinde ve hayat bilimlerinde yaygınca kullanılır.
Biyokimyada metilasyon daha spesifik olarak bir hidrojen atomunun bir metil grubuyla yer değiştirmesi anlamında kullanılır.
Biyolojik sistemlerde metilasyon enzimler tarafından katalizlenir; bu reaksiyon, ağır metallerin modifikasyonunda, gen ifadesinin denetlenmesinde, protein işlevlerinin denetlenmesinde ve RNA metabolizmasında yer alır. Ağır metallerin metilasyonu biyolojik sistemler dışında da olur. Histolojide doku örneklerinin kimyasal metilasyonu bazı histolojik boya artifaktlarının azaltılmasında kullanılan bir yöntemdir.
Biyolojik metilasyon
[değiştir | kaynağı değiştir]Epigenetik
[değiştir | kaynağı değiştir]Epigenetik kalıtıma etki eden metilasyon DNA metilasyonu veya protein metilasyonu ile meydana gelir.
DNA metilasyonu omurgalılarda tipik olarak CpG bölgelerinde (sitozin-fosfat-guanin bölgeleri; yani DNA dizisinde sık olarak sitozinin hemen ardından guaninin geldiği yerler); bu metilasyon sonucu sitozinden 5-metil sitozin meydana gelir. Me-CpG oluşumu DNA metiltransferaz enzimi tarafından katalizlenir. Omurgali hayvanlarin genomlarinda CpG dizileri genelde seyrek olmakla beraber gen promotörlerinde normalden yüksek sıklıkta görülürler ve toplu olarak bu bölgelere CpG adaları denir. Bu CpG bölgelerinin metilasyon durumu gen ifadesi üzerinde büyük etkide bulunur.
Protein metilasyonu tipik olarak protein dizisindeki arginin veya lizin amino asit kalıntılarında yer alır.[1] Arginin peptidilarginin metiltransferazlar tarafından bir kere (monometillenmiş arginin) veya iki kere metillenebilir; iki kere metillenme durumunda ise ya her iki metil grubu birden uçtaki azot üzerinde bulunabilir (asimetrik iki metilli arginin) veya her bir azot atomu üzerinde birer metil grubu bulunur (simetrik iki metilli arginin). Lizin ise lizin metiltransferazlar tarafından bir, iki veya üç kere metillenebilir. Protein metilasyonu en çok histonlar için çalışılmıştır. S-adenozil metyoninden metil gruplarının histonlara aktarılması histon metiltransferaz olarak adlandırılan enzimler tarafından gerçekleştirilir. Belli amino asit kalıntıları üzerinde metillenmiş olan histonlar epigenetik biçimde etki ederek gen ifadesini etkinleştirebilir veya engelleyebilirler.[2][3]
Protein metilasyonu bir tip çevrim sonrası değişimdir.
Embriyonik gelişim
[değiştir | kaynağı değiştir]Memelilerin erken gelişiminde (döllenmeden sekiz hücre aşamasına kadar) genom metilsizlenmiştir. Sekiz hücre aşamasından morulaya kadar genomda yeni baştan metilasyon olur, böylece genomdaki epigenetik bilgi değişir veya yeni epigenetik bilgi eklenir. Blastula aşamasında, metilasyon tamalanmıştır. Bu süreç "epigenetik yeniden programlama" olarak adlandırılır.[4] DNA metiltransferaz enzimi olmayan gen nakavt mutant hayvanların morula aşamasında öldüğünün gözlemlenmesi ile metilasyonun önemi ortaya çıkmıştır.[kaynak belirtilmeli]
Doğum sonrası gelişim
[değiştir | kaynağı değiştir]Metilasyon ile çevresel faktörlerin etkileşiminin gen ifadesine olan etkisine dair deliller gittikçe çoğalmaktadır. Sıçanlarda ilk altı ay zarfında anne bakımındaki farklılıklar bazı promotörlerde farklı metilasyon örüntülerine yol açmakta ve dolayısıyla gen ifadesine etki etmektedir.[5] Buna ilaveten, interlökin sinyalizasyonu gibi daha da hızlı süreçlerin de metilasyon ile denetlendiği gösterilmiştir.[6]
Kanser
[değiştir | kaynağı değiştir]Metilasyon örüntüleri kanser alanında önemli bir araştırma konusu olmuştur. Normal dokularda gen metilasyonu başlıca kodlayıcı bölgelerde konumlanmıştır ki bunlar CpG-fakiridir. Buna karşın genlerin promotör bölgeleri metillenmemiştir, CpG adalarının bu bölgelerdeki çokluğuna rağmen.
Neoplazi metilasyon dengesizliği ile karakterizedir; genom çapında hipometilasyon olmasına karşın yerel olarak hipermetilasyon bölgeleri vardır ve DNA metiltransferaz ifadesi artmıştır.[7]
Bir hücrenin toplam metilasyon durumu karsinogeneze sürükleyici bir faktör olabilir, çünkü genom çapında metilasyonun kromozom istikrarsızlığı ve artan mutasyon oranına yol açtığını gösterir deliller vardır.[8] Bazı genlerin metilasyon durumu tümörigenez için bir biyomarker olarak kullanılabilir. Örneğin, pi-sınıf glutatyon S-transferaz geninin (GSTP1'in) aşırı metilasyonu (hipermetilasyonu) prostat kanseri için ümit verici bir diagnostik indikatör olarak görünmektedir.[9]
Kanserde genetik ve epigenetik gen susturmalarının mekanizmaları çok farklıdır. Somatik genetik mutasyonlar mutan genden işlevsel proteinlerin üretmini engeller. Eğer hücreye selektif bir avantaj sağlarsa bu mutasonu taşıyan hücreler klonal şekilde çoğalarak bir tümör meydana getirirler, bu tümördeki tüm hücreler o proteini üretmekten acizdir. Buna karşın, epigenetik modifikasyon aracılığıyla gen susturması tedrici olur. Önce transkripsiyonda az fark edilir bir azalma ile başlar, bunun sonucu çevreleyen heterokromatin tarafından CpG adalarının koruması azalır. Bu kaybı takiben CpG adalarındaki metilasyon seviyesi artmaya başlar, bu değişiklikler farklı hücrelerde bulunan aynı genin kopyaları için farklı farklı kendini gösterir.[10]
Bakteriyel konak savunması
[değiştir | kaynağı değiştir]Adenozin ve sitozin metilasyonu çoğu bakteride bulunan restriksiyon modifikasyon sisteminin parçasıdır. Bakteriyel DNA periyodik olarak tüm genomda metillenir. Metilaz, belli bir DNA dizisini tanıyan ve bu dizi içinde veya yakınındaki bazlardn birini metilleyen bir enzimdir. Bu şekilde metillenmeden hücre içinde giren yabancı DNA'lar diziye özgün restriksiyon enzimleri tarafından yıkılır. Bu restriksiyon enzimleri bakteriyel genomik DNA'yı tanımazlar. İçsel DNA'nın metilasyonu bir çeşit ilkel bağışıklık sistemi olarak etki eder, bakterileri bakteriyofaj enfeksiyonuna karşı korur.
Kimya
[değiştir | kaynağı değiştir]Organik kimyada metilasyon terimi CH3 grubunun eklendiği alkilasyon sürecine değinmek için kullanılır.[11] Bunu yapmak için SN2 nükleofilik sübstitüsyon ile tepkiyen elektrofilik metil kaynakları kullanılır. Kullanılan reaktanlar başlıca iyodometan, dimetil sülfat, dimetil karbonat ve daha güçlü (ve tehlikeli) oldukları için daha ender kulanıllan metil triflat veya metil fluorosulfonat (sihirli metil). Örneğin bir karboksilat, oksijen üzerinde metillenip bir metil ester verir. Bir alkoksit tuz (RO-) benzer şekilde metillenip bir eter verir.
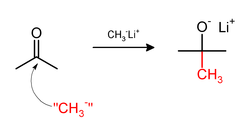
Alternatif olarak metil lityum (CH3Li) veya Grignard reaktifi (CH3MgX) gibi nüklofilik metil bileşiklerle de metilasyon yapılabilir. Örneğin CH3Li asetonu metillemekte kullanıldığında karbonil (C=O) bağına metili ekleyerek tert-butanol'un lityum alkoksitini meydana getirir:
Purdie metilasyonu
[değiştir | kaynağı değiştir]Purdie metilasyonu, karbonhidratlardaki oksijenin iyodometan ve gümüş oksit ile spesifik bir metilasyon yöntemidir.[12]
Ayrıca bakınız
[değiştir | kaynağı değiştir]- Bisülfit dizileme - Bir DNA dizisinde metil gruplarının varlığı ve yokluğunu belirlemek için kullanılan biyokimyasal yöntem.
Kaynakça
[değiştir | kaynağı değiştir]- ^ Christopher Walsh (2006). "Chapter 5 - Protein Methylation". Posttranslational modification of proteins: expanding nature's inventory. Roberts and Co. Publishers. ISBN 0-9747077-3-2.
- ^ Grewal SI, Rice JC (2004). "Regulation of heterochromatin by histone methylation and small RNAs". Curr. Opin. Cell Biol. 16 (3). ss. 230-8. doi:10.1016/j.ceb.2004.04.002. PMID 15145346. 2 Temmuz 2018 tarihinde kaynağından arşivlendi. Erişim tarihi: 3 Ağustos 2009.
- ^ Nakayama J, Rice JC, Strahl BD, Allis CD, Grewal SI (2001). "Role of histone H3 lysine 9 methylation in epigenetic control of heterochromatin assembly". Science. 292 (5514). ss. 110-3. doi:10.1126/science.1060118. PMID 11283354.
- ^ Mann MRW, Bartolomei MS (2002):"Epigenetic reprogramming in the mammalian embryo: struggle of the clones": Genome Biology (2002), 3: 1003.1-1003.4
- ^ Weaver IC (2007). "Epigenetic programming by maternal behavior and pharmacological intervention. Nature versus nurture: let's call the whole thing off". Epigenetics. 2 (1). ss. 22-8. PMID 17965624.
- ^ Bird A (2003). "Il2 transcription unleashed by active DNA demethylation". Nat. Immunol. 4 (3). ss. 208-9. doi:10.1038/ni0303-208. PMID 12605226.
- ^ Baylin SB, Herman JG, Graff JR, Vertino PM, Issa JP (1998). "Alterations in DNA methylation: a fundamental aspect of neoplasia". Adv. Cancer Res. Cilt 72. ss. 141-96. doi:10.1016/S0065-230X(08)60702-2. PMID 9338076.
- ^ Chen RZ, Pettersson U, Beard C, Jackson-Grusby L, Jaenisch R (1998). "DNA hypomethylation leads to elevated mutation rates". Nature. 395 (6697). ss. 89-93. doi:10.1038/25779. PMID 9738504.
- ^ Nakayama M, Gonzalgo ML, Yegnasubramanian S, Lin X, De Marzo AM, Nelson WG (2004). "GSTP1 CpG island hypermethylation as a molecular biomarker for prostate cancer". J. Cell. Biochem. 91 (3). ss. 540-52. doi:10.1002/jcb.10740. PMID 14755684.
- ^ Jones PA, Baylin SB (2002). "The fundamental role of epigenetic events in cancer". Nature Reviews Genetics. 3 (6). ss. 415-28. doi:10.1038/nrg816. PMID 12042769.
- ^ March, Jerry; Smith, Michael W. (2001). March's advanced organic chemistry: reactions, mechanisms, and structure. New York: Wiley. ISBN 0-471-58589-0.
- ^ The alkylation of sugars Purdie, T.; Irvine, J. C. J. Chem. Soc. 1903, 83, 1021–1037 DOI:10.1039/CT9038301021
Dış bağlantılar
[değiştir | kaynağı değiştir]- "DNA Metilasyon veritabanı". 1 Haziran 2017 tarihinde kaynağından arşivlendi.
- "deltaMasses". 18 Nisan 2016 tarihinde kaynağından arşivlendi.
Kütle Spektrometrisinde metilasyon teşhisi