Ethaan
| Ethaan | ||||
|---|---|---|---|---|
| Structuurformule en molecuulmodel | ||||
| ||||
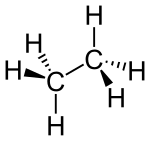
Structuurformule van ethaan
| ||||
| ||||
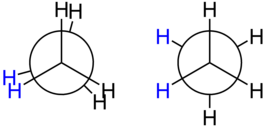
Newmanprojectie van een geëclipseerde (links) en een geschrankte conformatie (rechts) van ethaan
| ||||
| Algemeen | ||||
| Molecuulformule | C2H6 | |||
| IUPAC-naam | ethaan | |||
| Molmassa | 30,06904 g/mol | |||
| SMILES | CC
| |||
| InChI | 1S/C2H6/c1-2/h1-2H3
| |||
| CAS-nummer | 74-84-0 | |||
| EG-nummer | 200-814-8 | |||
| PubChem | 6324 | |||
| Wikidata | Q52858 | |||
| Beschrijving | Kleurloos gas | |||
| Vergelijkbaar met | methaan | |||
| Waarschuwingen en veiligheidsmaatregelen | ||||
| ||||
| H-zinnen | H220 - H280 | |||
| EUH-zinnen | geen | |||
| P-zinnen | P210 - P410+P403 | |||
| Opslag | Brandveilig en koel bewaren. | |||
| VN-nummer | 1035 | |||
| Fysische eigenschappen | ||||
| Aggregatietoestand | gasvormig | |||
| Kleur | kleurloos | |||
| Smeltpunt | −183,3 °C | |||
| Kookpunt | −88,63 °C | |||
| Vlampunt | −135 °C | |||
| Zelfontbrandings- temperatuur | 515 °C | |||
| Dampdruk | 3,85 × 106 Pa | |||
| Oplosbaarheid in water | (bij 20°C) 4,7 g/L | |||
| Slecht oplosbaar in | water | |||
| Thermodynamische eigenschappen | ||||
| ΔfH |
−84,68 kJ/mol | |||
| S |
229,60 J/mol·K | |||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | ||||
| ||||
Ethaan is een verzadigde koolwaterstof, met als brutoformule C2H6. Het is het op een na meest eenvoudige alkaan. Van ethaan is de ethylgroep afgeleid, een veelvoorkomende alkylgroep in de organische chemie.
Eigenschappen en voorkomen
[bewerken | brontekst bewerken]Ethaan is onder normale omstandigheden een kleur- en reukloos gas, dat zeer slecht oplosbaar is in water. Bij 20 °C lost amper 61 milligram op in 1 liter water. Het is naast methaan een bestanddeel van aardgas.
Synthese
[bewerken | brontekst bewerken]In het laboratorium kan ethaan bereid worden middels de Kolbe-elektrolyse. Hierbij wordt een waterige oplossing van een acetaat (zoals natriumacetaat) geëlektrolyseerd. Aan de anode wordt het acetaat-ion geoxideerd tot koolstofdioxide en een methyl-radicaal. Dit uiterst reactieve radicaal reageert met een ander methyl-radicaal tot ethaan:
Een gelijkaardige methode is de oxidatie van azijnzuuranhydride met een peroxide.
Structurele eigenschappen en conformaties
[bewerken | brontekst bewerken]De bindingslengte van de koolstof-koolstofbinding bedraagt 153,51 pm; die van de koolstof-waterstofbinding 109,40 pm. Alle bindingshoeken bedragen 109,5°, hetgeen volgt uit het feit dat beide koolstofatomen sp3-gehybridiseerd zijn.
Ethaan komt voor in 2 conformaties: een geëclipseerde en een geschrankte. Van beide conformaties is de geschrankte het meest stabiel (meest energetisch gunstig), omdat de waterstofatomen op de naburige koolstofatomen dan het verst van elkaar staan en dus geen ongunstige sterische interacties kunnen aangaan. De overgangsenergie tussen beide conformaties bedraagt ongeveer 12,6 kJ/mol; dit wordt ook weleens de rotationele barrière genoemd.
Reacties
[bewerken | brontekst bewerken]Ethaan verbrandt onder ideale omstandigheden met zuurstofgas tot koolstofdioxide en water:
Naast de klassieke verbrandingsreactie kan ethaan gedehydrogeneerd worden tot etheen. Dit gebeurt door verhitting tot meer dan 700 °C:
Ethaan is in wezen een weinig reactieve verbinding. De enige manier om deze te functionaliseren is via een radicalaire substitutie met dichloor. Hierbij wordt - in enkele radicalaire stappen - een waterstofatoom vervangen door een chlooratoom. Deze reactie staat bekend als de radicalaire halogenering. Dit leidt tot vorming van chloorethaan, dat kan gebruikt worden om ethylgroepen in te voeren in andere verbindingen.
Toepassingen
[bewerken | brontekst bewerken]Ethaan wordt als aardgas voornamelijk gebruikt voor verwarming door verbranding. Het dient ook als grondstof voor synthese van etheen, azijnzuur en andere chemische verbindingen.
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Bij inademing van ethaan verhoogt de adem- en hartfrequentie. Bij opname van grotere hoeveelheden kunnen slapeloosheid, duizeligheid, misselijkheid en hyperventilatie optreden.
Ethaan is niet toxisch en niet corrosief, maar het is wel licht ontvlambaar. Het vlampunt ligt immers bij −135 °C.
Externe links
[bewerken | brontekst bewerken] ethaan - International Chemical Safety Card
ethaan - International Chemical Safety Card- (en) Gegevens van ethaan in de GESTIS-stoffendatabank van het IFA
- (en) MSDS van ethaan

