Lood(II)chloride
| Lood(II)chloride | |||||
|---|---|---|---|---|---|
| Structuurformule en molecuulmodel | |||||
| |||||
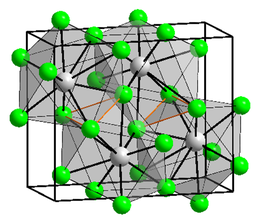
Kristalstructuur van lood(II)chloride
| |||||

| |||||
Lood(II)chloride-kristallen
| |||||
| Algemeen | |||||
| Molecuulformule | PbCl2 | ||||
| IUPAC-naam | lood(II)chloride | ||||
| Andere namen | looddichloride | ||||
| Molmassa | 278,10 g/mol | ||||
| CAS-nummer | 7758-95-4 | ||||
| Wikidata | Q411848 | ||||
| Beschrijving | Witte, reukloze kristallen | ||||
| Waarschuwingen en veiligheidsmaatregelen | |||||
| |||||
| H-zinnen | H302 - H332 - H360 - H373 - H410 | ||||
| EUH-zinnen | geen | ||||
| P-zinnen | P201 - P273 - P308+P313 - P501 | ||||
| VN-nummer | 2291 | ||||
| Fysische eigenschappen | |||||
| Dichtheid | 5,85 g/cm³ | ||||
| Smeltpunt | 501 °C | ||||
| Kookpunt | 950 °C | ||||
| Oplosbaarheid in water | (bij 0°C) 6,73 g/L (bij 20°C) 9,9 g/L (bij 100°C) 33,4 g/L | ||||
| Slecht oplosbaar in | water, ethanol | ||||
| Brekingsindex | 2,199[1] | ||||
| Geometrie en kristalstructuur | |||||
| Kristalstructuur | orthorombisch | ||||
| Tenzij anders vermeld zijn standaardomstandigheden gebruikt (298,15 K of 25 °C, 1 bar). | |||||
| |||||

Lood(II)chloride is een anorganische verbinding van lood, met als brutoformule PbCl2. De stof komt voor als een wit kristallijn poeder, dat slecht oplosbaar is in water. Lood(II)chloride is een van de belangrijkste loodhoudende reagentia. Het komt in de natuur voor als het mineraal cotunniet. De stof kwam voor in de uitlaatgassen van inwendige verbrandingsmotoren waarin 1,2-dichloorethaan en tetraethyllood als antiklopmiddel werden gebruikt.
Synthese
[bewerken | brontekst bewerken]Lood(II)chloride kan rechtstreeks bereid worden uit de samenstellende elementen:
Een alternatieve methode is de neerslagreactie tussen lood(II)nitraat en een chloride-zout, zoals natriumchloride:
Het kan ook bereid worden door reactie van lood(II)carbonaat met waterstofchloride:
Eigenschappen en reacties
[bewerken | brontekst bewerken]Oplosbaarheid
[bewerken | brontekst bewerken]De oplosbaarheid van lood(II)chloride in water is laag (9,9 g/L bij 20 °C) en om deze reden wordt het onder de in water onoplosbare zouten gerekend. Het oplosbaarheidsproduct (Ks) bij 25 °C bedraagt 1,6 × 10−5. Lood(II)chloride is daarmee een van de drie onoplosbare chloride-zouten, naast zilverchloride en kwik(I)chloride.[2] Opmerkelijk is het grote verschil in oplosbaarheid bij kamertemperatuur en bij 100 °C: ze is namelijk ongeveer 4 keer groter. Dit verschijnsel wordt in de kwalitatieve analyse van ionen gebruikt om de drie chloriden van elkaar te kunnen onderscheiden.
Oplosbare chloride-complexen
[bewerken | brontekst bewerken]Als aan een suspensie van lood(II)chloride extra chloride-ionen worden toegevoegd, dan worden complexe ionen gevormd. Bij de reactie tussen het vaste lood(II)chloride en de extra ligand worden de chloride-bruggen die in het vaste lood(II)chloride het polymere netwerk vormen verbroken.
Synthese van organoloodverbindingen
[bewerken | brontekst bewerken]Lood(II)chloride is de voornaamste bron van lood bij de synthese van organische loodverbindingen. Als bron voor de alkylgroepen wordt gebruikgemaakt van Grignard-reagentia en organolithiumverbindingen:
Bij een 3:6-stoichiometrie wordt een diloodcomplex gevormd:[3]
In al deze reacties gedraagt lood zich meer als een echt lid van de koolstofgroep dan als een metaal: Pb(II) disproportioneert naar Pb(IV) en Pb(0) tijdens de alkylering.
Omzetting naar oxiden
[bewerken | brontekst bewerken]Lood(II)chloride reageert met gesmolten natriumnitriet tot lood(II)oxide:
Lood(II)chloride wordt ook gebruikt in de bereiding van keramiek via een kation-uitwisselingsreactie:[4]
Kristalstructuur
[bewerken | brontekst bewerken]In vast lood(II)chloride wordt elk loodatoom door 9 chlooratomen omringd. Zes daarvan vormen de hoekpunten van een trigonaal prisma, de overige drie chlooratomen liggen in de middens van de prisma-vlakken. De afstand van het loodatoom tot de 9 chlooratomen is niet gelijk: 7 liggen op afstanden tussen 280 tot 309 pm twee andere liggen op 370 pm.[5] Lood(II)chloride kristalliseert uit als witte orthorombische naaldvormige kristallen.
In de gasfase bezitten de lood(II)chloride-moleculen een gebogen moleculaire geometrie, waarbij de Cl-Pb-Cl-hoek 98° meet. Elke Pb-Cl-binding is 244 pm lang.[6]
Toepassingen
[bewerken | brontekst bewerken]Gesmolten lood(II)chloride wordt gebruikt in de bereiding van lood(II)titanaat (PbTiO3) en bariumlood(II)titanaat.[4] Lood(II)chloride wordt toegepast in de bereiding van een groep van metallocenen, met name de plumbocenen.[7]
Het wordt gebruikt in de productie van doorzichtig glas als bescherming tegen infrarode straling.[8]
Lood(II)chloride wordt gebruikt in de bereiding van sierglaswerk. Door het glaswerk van een dun laagje lood(II)chloride te voorzien en vervolgens onder gecontroleerde omstandigheden nogmaals te verwarmen ontstaat het speciale effect. Tin(II)chloride wordt voor hetzelfde doel gebruikt.[9]
Lood(II)chloride is een tussenstof in de zuivering van bismutertsen. Het erts, waarin naast bismut ook lood en zink voorkomen, wordt eerst met gesmolten natriumhydroxide behandeld om sporen van zuurvormende elementen als arseen en telluur te verwijderen. Vervolgens wordt de Parkes-desilverisatie toegepast om sporen zilver en goud te verwijderen. Nu zijn alleen bismut, lood en zink nog aanwezig in het erts dat bij 500 °C met chloorgas behandeld wordt. Het als eerste gevormde zinkchloride wordt verwijderd, waarna het dan ontstane lood(II)chloride ook verwijderd wordt. Bismut blijft uiteindelijk over.[10]
Toxicologie en veiligheid
[bewerken | brontekst bewerken]Net zoals alle andere loodhoudende verbindingen, kan blootstelling aan lood(II)chloride een loodvergiftiging veroorzaken.
Externe link
[bewerken | brontekst bewerken]- ↑ Pradyot Patnaik. Handbook of Inorganic Chemicals. McGraw-Hill, 2002, ISBN 0070494398
- ↑ Brown, Lemay, Burnsten - Chemistry The Central Science, Solubility-Product Constants for Compounds at 25°C, ed. 6, 1994, p. 1017
- ↑ (en) Housecroft & Sharpe (2005) - Inorganic Chemistry, (ed. 2), p. 524
- ↑ a b (en) A. Aboujalil et al. (1998) - Molten salt synthesis of the lead titanate PbTiO3, investigation of the reactivity of various titanium and lead salts with molten alkali-metal nitrites, J. Mater. Chem., 8, pp. 1601–1606]
- ↑ (en) A.F. Wells (1984) - Structural Inorganic Chemistry (5th edition), Oxford Science Publications - ISBN 0-19-855370-6
- ↑ (en) I. Hargittai et al. (1977) - Two independent gas electron diffraction investigations of the structure of plumbous chloride, J. Mol. Struct., 42, pp. 147-151]
- ↑ (en) R.H. Lowack et al. (1994) - Decasubstituted decaphenylmetallocenes, J. Organomet. Chem., 476, pp. 25-32]
- ↑ (en) Dictionary of Inorganic and Organometallic Compounds: Lead(II) Chloride
- ↑ Stained Glass Terms and Definitions: aurene glass. Gearchiveerd op 26 juni 2021.
- ↑ Kirk-Othmer - Encyclopedia of Chemical Technology (ed. 4), p. 241


